题目内容
【题目】下图所涉及的物质均为中学化学中的常见物质,其中C、D均为气体单质,E是固体单质,A物质的焰色反应火焰为紫色,F是黑色晶体,它们存在如图转化关系,反应中生成的水及次要产物均的已略去。
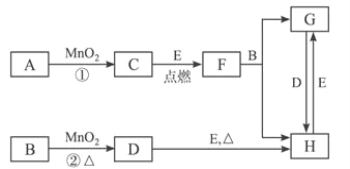
(1)写出下列物质的化学式:C_____________,D______________,H____________。
(2)指出MnO2在相关反应中的作用:反应①中做_______剂,反应②中做_________剂。
(3)当①中有1molA完全反应时转移电子的物质的量是________mol。
(4)检验G中阳离子的方法_________________________________________ 。
(5)保存G溶液时为什么要加固体E_____________________________________。
(6)写出F→G+H的离子方程式:____________________________________。
【答案】 O2 Cl2 FeCl3 催化(剂) 氧化(剂) 1 取少量试液于试管中,滴加硫氰化钾溶液无明显变化,往溶液中通入氯气后溶液呈血红色,则说明存在Fe2+ 防止Fe2+被氧化 Fe3O4+8H+=Fe2++2Fe3++4H2O
【解析】与MnO2反应制备的气体有O2和Cl2,其中在不加热条件下,用H2O2和MnO2制备O2,在加热条件下用浓盐酸和MnO2制备Cl2,则A为H2O2,B为HCl,C为O2,D为Cl2,F为是黑色晶体,与盐酸反应生成两种氯化物,且二者之间可以相互转化,说明E为变价金属,应为Fe,则F为Fe3O4,G为FeCl2,H为FeCl3,则
(1)根据以上分析可知C、D、H的化学式分别是O2、Cl2、FeCl3。(2)根据以上分析可知反应①中二氧化锰做催化剂,反应②中做氧化剂。(3)①中氧元素化合价从-1价升高到0价,另外部分从-1价降低到-2价,则有1molH2O2完全反应时转移电子的物质的量是1mol。(4)检验亚铁离子的方法为取少量试液于试管中,滴加硫氰化钾溶液无明显变化,往溶液中通入氯气后溶液呈血红色,则说明存在Fe2+。(5)亚铁离子易被氧化,因此保存亚铁离子溶液时要加固体铁的原因是防止Fe2+被氧化。(6)根据以上分析可知F→G+H的离子方程式为Fe3O4+8H+=Fe2++2Fe3++4H2O。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案【题目】下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是( )
纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
A | 盐酸 | 醋酸 | 碳酸 | 氨水 | 氯水 |
B | 纯碱 | 碘酒 | 苛性钾 | 冰醋酸 | 干冰 |
C | 石油 | 石灰石 | 硫酸 | 磷酸 | 水 |
D | 烧碱 | 天然气 | 氯化钠 | 碳酸钠 | 蔗糖 |
A. A B. B C. C D. D