题目内容
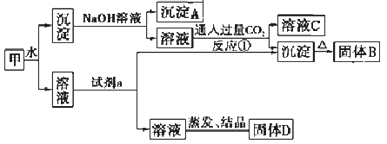
【题目】海水中有非常丰富的化学资源,从海水中可提取多种化工原料。某工厂对海水资源综合开发利用的部分工艺流程图如下。回答下列问题:

(1)精制食盐水时下列物质中,用到的有______________________(填序号)。
①NaOH溶液 ②盐酸 ③K2CO3溶液 ④BaCl2溶液 ⑤硫酸 ⑥Na2CO3溶液 ⑦Ba(NO3)2溶液
(2)工业上经过②、③、④制备Ba2。步骤②中Cl2氧化Br-应在________(填酸性或碱性)条件下进行;步骤③Br2可用热空气吹出,其原因是_____________________。
(3)为了除去工业Br2中微量的Cl2,可向工业Br2中____________________。
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液
(4)若步骤⑤所得Mg(OH)2沉淀中混有Ca(OH)2杂质,写出除去杂质的实验步骤 ________________(写出加入的试剂和操作)。
【答案】 ①②④⑥ 酸性 低沸点,易挥发 c 加入MgCl2溶液,充分搅拌,过滤,用蒸馏水洗涤沉淀
【解析】(1)精制食盐水时,可以加入过量NaOH(去除镁离子和铁离子):Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓;加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓,用盐酸除掉过量的CO32-、OH-,因此用到的有①②④⑥,其他③⑤⑦的都用不到,故答案为:①②④⑥;
(2)Cl2氧化Br-生成溴单质,则应在酸性条件下进行,防止溴中毒及生成的溴与碱发生反应(且碱性溶液中氯气与碱反应),因溴的沸点较低,易挥发,Br2可用热空气吹出,故答案为:酸性;溴的沸点较低,易挥发;
(3)为了除去工业Br2中微量的Cl2,应是和氯气反应和溴单质不反应;a、加入HBr,氯气可以发生反应生成挥发性的盐酸,会引入新的杂质,故a不符合;b、加入Na2CO3溶液也可以和溴单质、氯气发生反应,b不符合;c、加入NaBr溶液,发生反应Cl2+2NaBr=Br2+2NaCl,故c符合;d、加入Na2SO3溶液能除去氯气,但会引入杂质离子,故d不符合;故答案为:c;
(5)溶度积常数大的物质可以向溶度积常数小的物质转化,氢氧化钙的溶度积常数大于氢氧化镁,所以加入氯化镁溶液,充分搅拌,过滤,沉淀用水洗涤得到氢氧化镁固体,故答案为:加入MgCl2溶液,充分搅拌,过滤,沉淀用蒸馏水洗涤。