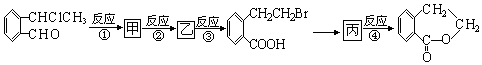题目内容
【题目】钢铁分析中常用高氯酸(HClO4)溶解矿样,某研究性学习小组欲制备少量高氯酸。该学习小组查阅到:a.HClO4浓度高于60%时遇含碳化合物易爆炸,浓度低于60%时比较稳定;b.NaClO4与浓硫酸反应可制得高氯酸,若采用真空蒸馏可得纯高氯酸;c.NaClO3 在673K(400℃)分解产生NaClO4、NaCl和一种气体。该小组同学设计实验分三步制备高氯酸;(一)制氯气并使制得的氯气与氢氧化钠溶液反应制氯酸纳;(二)氯酸钠分解制高氯酸钠;(三)高氯酸纳与浓硫酸反应制高氯酸[2NaClO4+H2SO4(浓) ![]() Na2SO4+2HClO4 ]。
Na2SO4+2HClO4 ]。
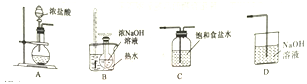
(1)制取氯酸钠的装置连接顺序为A,____________。由装置可知该小组制氯气时采用的氧化剂可以为___________(填化学式)。
(2)B装置中发生反应的离子方程式为_________________________。
(3)为了制备高氯酸钠并推出氯酸钠分解制高氯酸钠的化学方程式,该小组设计了两组装置(甲,乙)如下:

该小组经过分析决定选用甲装置制备高氯酸钠,取NaClO3样品2.13 g,加热充分反应后集气瓶中收集到224 mL(标准状况下)气体,则该反应的化学方程式为_____________________;不选用乙装置的原因可能为____________________。
(4)用丙装置制备高氯酸,向烧瓶中加入高氯酸钠,然后加入浓硫酸后,加热可制取高氯酸。实验开始前,胶塞及导管接口需要包锡箔纸,其原因是_________________,仪器E的名称为________。该组同学发现操作中少加入一种物质,该物质的名称为________。发现后的正确操作为_____________。
(5)工业上大量制备NaClO4 常用高电流密度电解NaClO3 的方法,试写出以惰性电极电解时的阳极反应式:___________________________________。
【答案】 C,B,D KMnO4 Cl2+ 6OH-![]() 5Cl- +ClO3-+3H2O 2NaClO3
5Cl- +ClO3-+3H2O 2NaClO3![]() NaClO4+NaCl+O2 乙装置不能快速判断氯酸钠是否完全反应且反应后气体无法收集 橡胶中含有“碳”,若生成的高氯酸浓度高时遇胶塞及导管极有可能会爆炸 锥形瓶 碎瓷片(或沸石) 停止实验,冷却后加入碎瓷片(或沸石)再继续进行实验 ClO3--2e+H2O==ClO4-+2H+
NaClO4+NaCl+O2 乙装置不能快速判断氯酸钠是否完全反应且反应后气体无法收集 橡胶中含有“碳”,若生成的高氯酸浓度高时遇胶塞及导管极有可能会爆炸 锥形瓶 碎瓷片(或沸石) 停止实验,冷却后加入碎瓷片(或沸石)再继续进行实验 ClO3--2e+H2O==ClO4-+2H+
【解析】本题主要考查对于制备高氯酸探究实验的评价。
(1)A制取的氯气通过C除去氯化氢杂质,在B制得的氯气与氢氧化钠溶液反应制氯酸纳,用D吸收氯气的余气,防止污染环境,所以制取氯酸钠的装置连接顺序为A,C,B,D。制取氯气的装置不需要加热,由装置可知该小组制氯气时采用的氧化剂可以为KMnO4。
(2)B装置中发生反应的离子方程式为Cl2+6OH-![]() 5Cl-+ClO3-+3H2O。
5Cl-+ClO3-+3H2O。
(3)该小组经过分析决定选用甲装置制备高氯酸钠,2.13gNaClO3样品的物质的量为0.02mol,224mL(标准状况下)气体的物质的量为0.01mol,则该反应的化学方程式为2NaClO3![]() NaClO4+NaCl+O2;不选用乙装置的原因可能为乙装置不能快速判断氯酸钠是否完全反应且反应后气体无法收集。
NaClO4+NaCl+O2;不选用乙装置的原因可能为乙装置不能快速判断氯酸钠是否完全反应且反应后气体无法收集。
(4)实验开始前,胶塞及导管接口需要包锡箔纸,其原因是橡胶中含有“碳”,若生成的高氯酸浓度高时遇胶塞及导管极有可能会爆炸,仪器E的名称为锥形瓶。该组同学发现操作中少加入一种物质,该物质的名称为碎瓷片(或沸石)。发现后的正确操作为停止实验,冷却后加入碎瓷片(或沸石)再继续进行实验。
(5)以惰性电极电解时的阳极反应式:ClO3--2e+H2O==ClO4-+2H+。