题目内容
【题目】如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只分析图形不能得出的结论是( ) 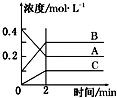
A.A是反应物
B.前2 min A的分解速率为0.1 molL﹣1min﹣1
C.达平衡后,若升高温度,平衡向正反应方向移动
D.反应的方程式为:2A(g)2B(g)+C(g)
【答案】C
【解析】解:A、由图象可知,A的物质的量浓度减小,B和C的物质的量浓度增加,则A为反应物,B和C为生成物,故A正确;B、由图可知前2 minA的△c(A)=0.2mol/L,所以v(C)= ![]() =0.1 molL﹣1min﹣1 , 故B正确;
=0.1 molL﹣1min﹣1 , 故B正确;
C、根据图象不能确定该反应的反应热,不能判断温度对平衡移动的影响,故C错误;
D、由反应的浓度的变化之比等于化学计量数之比可得:△c(A):△c(B):△c(C)=0.2mol/L:0.2mol/L:0.1mol/L=2:2:1,则反应的化学方程式为2A2B+C,故D正确;
故选C.

练习册系列答案
相关题目
