题目内容
13.下列关于CH3+、-CH3、CH3-三种微粒的说法正确的是( )| A. | 三种微粒都能独立稳定存在 | B. | 三种微粒的形状相同 | ||
| C. | 三种微粒中碳原子的杂化方式相同 | D. | 键角大小关系:CH3+>CH3- |
分析 碳原子最外层4个电子,则CH3+是缺电子的碳正离子,可看作是甲基失去一个电子后的产物,甲基的电子式为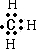 ,则CH3+的电子式为
,则CH3+的电子式为 ,CH3-是多电子的碳负离子,可以可作是甲基得到一个电子后的产物,CH3-的电子式为
,CH3-是多电子的碳负离子,可以可作是甲基得到一个电子后的产物,CH3-的电子式为 ,
,
A.三种微粒都不能独立稳定存在;B.三种微粒的形状不相同;C.根据价层电子对互斥理论确定中心原子杂化类型,价层电子对个数=σ键个数+孤电子对个数;D.根据微粒杂化及空间构型判断键角大小关系:CH3+>CH3-.
解答 解:A.CH3+、-CH3、CH3-三种微粒分别为碳正离子、甲基、碳负离子,三种微粒都不能独立稳定存在,故A错误;
B.甲基是甲烷去掉一个氢原子空间构型为正四面体型,碳正离子其中心碳原子采用sp2杂化,不含孤对电子,空间构型为平面三角形结构,碳负离子其中心碳原子采用sp3杂化,含有一对孤对电子为三角锥型,三种微粒的形状不相同,故B错误;
C.甲基中的C原子价层电子对个数=4+$\frac{1}{2}$(4-4×1)=4,所以其中心碳原子采用sp3杂化,碳正离子中的C原子价层电子对个数=3+$\frac{1}{2}$(3-3×1)=3,所以其中心碳原子采用sp2杂化,碳负离子中的C原子价层电子对个数=4+$\frac{1}{2}$(4-4×1)=4,所以其中心碳原子采用sp3杂化,三种微粒中碳原子的杂化方式不同,故C错误;
D.CH3+呈平面三角形结构,所以键角约为120°,碳负离子其中心碳原子采用sp3杂化,含有一对孤对电子为三角锥型,键角约为104.5°,所以键角大小关系:CH3+>CH3-,故D正确;
故选D.
点评 本题考查关于CH3+、-CH3、CH3-三种微粒的结构知识,侧重考查微粒空间构型判断等知识点,以甲基为例采用知识迁移的方法解答问题,题目难度中等.

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案| A. | KIO3 | B. | 苯甲酸钠 | C. | 维生素E | D. | NaNO2 |
| A. | 元素的非金属性:X>Y>Z | B. | 原子半径:X>Y>Z | ||
| C. | 气态氢化物稳定性:X<Y<Z | D. | 原子序数:Z>Y>X |
| A. | 正极附近SO42-浓度逐渐增大 | |
| B. | 电子通过导线由铜片流向锌片 | |
| C. | 正极反应式为Zn-2e-═Zn2+ | |
| D. | 该原电池工作过程中电解质溶液的pH值增大 |
| A. | 溶液中阴离子物质的量基本不变 | |
| B. | 正极的电极反应式是:O2+4H++4e-═2H2O | |
| C. | 正极的电极反应式是:N2H4+4OH--4e═4H2O+N2↑ | |
| D. | 溶液中阴离子向正极移动 |
| A. | 含氧的化合物一定是氧化物 | B. | 酸根中不一定含有氧元素 | ||
| C. | 盐的组成中一定含有金属元素 | D. | 酸中一定不含金属元素 |
 氧元素与多种元素具有亲和力,所形成化合物的种类很多.
氧元素与多种元素具有亲和力,所形成化合物的种类很多.