题目内容
1.X、Y、Z是同周期的三种元素,已知其最高价氧化物对应的水化物的酸性由强到弱的顺序是HXO4>H2YO4>H3ZO4.则下列说法正确的是( )| A. | 元素的非金属性:X>Y>Z | B. | 原子半径:X>Y>Z | ||
| C. | 气态氢化物稳定性:X<Y<Z | D. | 原子序数:Z>Y>X |
分析 同周期元素从左到右元素的非金属性逐渐增强,对应的最高价氧化物对应水化物的酸性逐渐增强,酸性相对强弱:HXO4>H2YO4>H3ZO4,可知非金属性X>Y>Z,原子序数X>Y>Z,再结合元素周期律解答.
解答 解:同周期元素从左到右元素的非金属性逐渐增强,对应的最高价氧化物对应水化物的酸性逐渐增强,酸性相对强弱:HXO4>H2YO4>H3ZO4,可知非金属性X>Y>Z,原子序数X>Y>Z.
A.最高价氧化物对应水化物的酸性是:HXO4>H2YO4>H3ZO4,则非金属性X>Y>Z,故A正确;
B.同周期自左而右原子半径减小,故原子半径:X<Y<Z,故B错误;
C.非金属性越强,氢化物越稳定,由于非金属性X>Y>Z,所以气态氢化物的稳定性:HX>H2Y>ZH3,故C错误;
D.由上述分析可知,原子序数:X>Y>Z,故D错误,
故选A.
点评 本题考查元素周期律知识,题目难度不大,注意相关性质的比较角度以及元素周期律的主要递变规律.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
8.根据下列某些短周期元素中元素性质的有关句回答问题.
(1)元素②、④、⑦和⑩的电负性由大到小的顺序是F>Cl>Al>Na(填元素符号).
(2)元素⑤、⑥和⑦的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质有CCl4、PCl3(写化学式).
(3)元素⑦离子的结构示意图 .
.
(4)元素①和⑨形成阳离子,其结构式为 ,其中心原子以sp3杂化轨道成键.
,其中心原子以sp3杂化轨道成键.
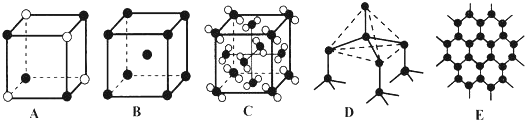
(5)元素②和⑦形成晶体的部分结构可用图中的A来表示.元素⑤最高价氧化物的晶体结构可以用下图C来表示.(填序号)
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
| 原子半径/10 -10m | 0.37 | 1.86 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.52 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | +3 | +4 | +5 | +7 | +1 | +5 | ||
| 最低价态 | -1 | -2 | -4 | -3 | -1 | -3 | -1 |
(2)元素⑤、⑥和⑦的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质有CCl4、PCl3(写化学式).
(3)元素⑦离子的结构示意图
 .
.(4)元素①和⑨形成阳离子,其结构式为
 ,其中心原子以sp3杂化轨道成键.
,其中心原子以sp3杂化轨道成键.(5)元素②和⑦形成晶体的部分结构可用图中的A来表示.元素⑤最高价氧化物的晶体结构可以用下图C来表示.(填序号)

12.用30g乙酸与46g乙醇反应,如果实际产率是理论产率的67%,则可得到的乙酸乙酯的质量是( )
| A. | 29.5g | B. | 44g | C. | 59 g | D. | 88g |
9.已知:
C(s)+O2(g)═CO2(g)△H1
CO2 (g)+C(s)═2CO(g)△H2
2CO (g)+O2(g)═2CO2(g)△H3
2Cu(s)+O2(g)═2CuO(s)△H4
CO(g)+CuO(s)═CO2(g)+Cu(s)△H5
下列关于上述反应焓变的判断正确的是( )
C(s)+O2(g)═CO2(g)△H1
CO2 (g)+C(s)═2CO(g)△H2
2CO (g)+O2(g)═2CO2(g)△H3
2Cu(s)+O2(g)═2CuO(s)△H4
CO(g)+CuO(s)═CO2(g)+Cu(s)△H5
下列关于上述反应焓变的判断正确的是( )
| A. | △H1>O,△H3<0 | B. | △H2<0,△H4>0 | C. | △H2=△H1-△H3 | D. | △H3=△H4+△H1 |
16.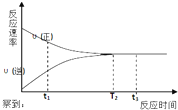 一定条件下的某可逆反应,其正反应速率v(正)和逆反应速率v(逆)随反应时间t的变化如图所示.下列判断不正确的是( )
一定条件下的某可逆反应,其正反应速率v(正)和逆反应速率v(逆)随反应时间t的变化如图所示.下列判断不正确的是( )
 一定条件下的某可逆反应,其正反应速率v(正)和逆反应速率v(逆)随反应时间t的变化如图所示.下列判断不正确的是( )
一定条件下的某可逆反应,其正反应速率v(正)和逆反应速率v(逆)随反应时间t的变化如图所示.下列判断不正确的是( )| A. | t1时刻,v(正)>v(逆) | B. | t2时刻,v(正)=v(逆) | ||
| C. | t2时刻,反应达到最大限度 | D. | t3时刻,反应停止 |
6.下列离子方程式正确的是( )
| A. | 过氧化钠与水的反应:2O22-+2H2O═4OH-+O2↑ | |
| B. | AlCl3和过量氨水反应:Al3++4OH-═AlO2?+2H2O | |
| C. | 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+Cl0-+2H+═Cl2↑+H20 | |
| D. | 等物质的量的Ba(OH)2与NaHSO4在溶液中反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
13.下列关于CH3+、-CH3、CH3-三种微粒的说法正确的是( )
| A. | 三种微粒都能独立稳定存在 | B. | 三种微粒的形状相同 | ||
| C. | 三种微粒中碳原子的杂化方式相同 | D. | 键角大小关系:CH3+>CH3- |
10.对下列有关实验的描述正确的是( )
| A. | 配制银氨溶液时,将硝酸银溶液逐滴滴入氨水中 | |
| B. | 乙醇中混有乙酸,加蒸馏水,然后分液 | |
| C. | 苯中混有苯酚,加浓溴水,然后分液 | |
| D. | 溴苯中混有溴,加NaOH溶液,然后分液 |
11.下列化学方程式或离子方程式中,正确的是( )
| A. | 向氢氧化钠溶液中通入少量CO2:CO2+NaOH═NaHCO3 | |
| B. | FeCl3溶液与Cu反应的离子方程式:Fe3++Cu═Cu2++Fe 2+ | |
| C. | 铜与浓硝酸:Cu+4HNO3(浓)═Cu(NO3)2+2NO↑+2H2O | |
| D. | 向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至刚好沉淀完全离子方程式:NH4++H++SO42-+Ba2++2OH-═BaSO4↓+NH3•H2O+H2O |