题目内容
8.在盛有稀硫酸的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )| A. | 正极附近SO42-浓度逐渐增大 | |
| B. | 电子通过导线由铜片流向锌片 | |
| C. | 正极反应式为Zn-2e-═Zn2+ | |
| D. | 该原电池工作过程中电解质溶液的pH值增大 |
分析 铜-锌-稀硫酸原电池中,活泼金属锌作负极,铜作正极;负极上锌失电子生成锌离子,正极上氢离子得电子生成氢气;溶液中阴离子向负极移动,阳离子向正极移动;由此分析解答.
解答 解:A、该原电池放电时,溶液中阴离子向负极移动,阳离子向正极移动,所以硫酸根离子向负极移动,负极附近SO42-浓度逐渐增大,故A错误;
B、铜-锌-稀硫酸原电池中,活泼金属锌作负极,铜作正极,原电池放电时,电子从负极锌沿导线流向正极铜,故B错误;
C、正极上氢离子得电子生成氢气,负极上锌失电子生成锌离子,故C错误;
D、该原电池中正极上氢离子得电子生成氢气,导致溶液中氢离子浓度降低,则电解质溶液的pH值增大,故D正确;
故选:D.
点评 本题考查了原电池原理,难度不大,易错点为:判断溶液中阴阳离子的移动方向.

练习册系列答案
相关题目
15.下列各组物质的晶体中,化学键类型和晶体类型均相同的是( )
| A. | NH3和NH4Cl | B. | HCl和SiO2 | C. | KCl和K | D. | CO2和H2O |
16.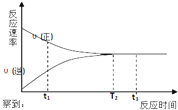 一定条件下的某可逆反应,其正反应速率v(正)和逆反应速率v(逆)随反应时间t的变化如图所示.下列判断不正确的是( )
一定条件下的某可逆反应,其正反应速率v(正)和逆反应速率v(逆)随反应时间t的变化如图所示.下列判断不正确的是( )
 一定条件下的某可逆反应,其正反应速率v(正)和逆反应速率v(逆)随反应时间t的变化如图所示.下列判断不正确的是( )
一定条件下的某可逆反应,其正反应速率v(正)和逆反应速率v(逆)随反应时间t的变化如图所示.下列判断不正确的是( )| A. | t1时刻,v(正)>v(逆) | B. | t2时刻,v(正)=v(逆) | ||
| C. | t2时刻,反应达到最大限度 | D. | t3时刻,反应停止 |
3.下列各化合物的命名中正确的是( )
| A. | 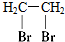 二溴乙烷 二溴乙烷 | B. | 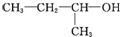 1-甲基-1-丙醇 1-甲基-1-丙醇 | ||
| C. |  4一甲基-戊烷 4一甲基-戊烷 | D. | 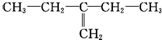 2-乙基-1-丁烯 2-乙基-1-丁烯 |
13.下列关于CH3+、-CH3、CH3-三种微粒的说法正确的是( )
| A. | 三种微粒都能独立稳定存在 | B. | 三种微粒的形状相同 | ||
| C. | 三种微粒中碳原子的杂化方式相同 | D. | 键角大小关系:CH3+>CH3- |
17.下列关于有机化合物的叙述中不正确的是( )
| A. | 丙烷跟甲烷一样能与氯气发生取代反应 | |
| B. | 1 mol乙酸与乙醇在一定条件下发生酯化反应,可生成1 mol乙酸乙酯 | |
| C. | CH2Cl2是纯净物说明甲烷是四面体结构而不是正方形结构 | |
| D. | 溴水既可鉴别乙烷与乙烯,又可除去乙烷中的乙烯而得到纯净的乙烷 |
18.下列分子和离子中,中心原子价层电子对的几何构型为四面体且分子或离子的空间构型为V形的是( )
| A. | OF2 | B. | SO2 | C. | H3O+ | D. | NH${\;}_{4}^{+}$ |