题目内容
7.在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )
| A. | a点Kw=1.0×10-14 mol2•L-2 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | b点:C(NH4+)>C(Cl-)>C(H+)>C(OH-) | |
| D. | 25℃时NH4Cl水解常数为(n-1)×10-7 mol•L-1(用n表示) |
分析 A.根据图象可知,a点时溶液温度小于25℃,则水的离子积小于1.0×10-14 mol2•L-2;
B.b点时溶液温度最高,说明氨水与盐酸恰好反应,则b点溶质为氯化铵,铵根离子促进了水的电离,则此时水的电离程度最大;由于d点溶液pH未知,则无法判断a、d两点水的电离程度大小;
C.该关系c(NH4+)>c(Cl-)>c(H+)>c(OH-)不满足电荷守恒;
D.25℃时溶液的pH=7,则c(H+)=c(OH-)=10-7 mol•L-1,c(NH4+)=c(Cl-)=0.5mol/L,根据物料守恒可知:c(NH3•H2O)=(0.5n-0.5)mol/L,然后结合铵根离子的水解平衡常数表达式计算.
解答 解:A.水的离子积与温度有关,a点时溶液温度小于25℃,则水的离子积Kw<1.0×10-14 mol2•L-2,故A错误;
B.b点溶液温度最高,说明此时两溶液恰好反应生成氯化铵,铵根离子水解促进了水的电离,则a、d两点都抑制了水的电离,则b点水的电离程度最大;由于d点混合液的pH不知,则无法判断a、d两点水的电离程度大小,故B错误;
C.b点时溶液的pH<7,则c(H+)>c(OH-),根据电荷守恒可知:c(Cl-)>c(NH4+),溶液中正确的离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故C错误;
D.根据图象可知,25℃时溶液的pH=7,则:c(H+)=c(OH-)=10-7 mol•L-1,c(NH4+)=c(Cl-)=0.5mol/L,根据物料守恒可知:c(NH3•H2O)=(0.5n-0.5)mol/L,则25℃时NH4Cl水解常数为:K=$\frac{0.5(n-1)×1{0}^{-7}}{0.5}$=(n-1)×10-7,故D正确;
故选D.
点评 本题考查了酸碱混合的定性判断及离子浓度大小比较,题目难度中等,涉及水的电离及其影响、酸碱混合的定性判断及溶液pH的计算、离子浓度大小比较、水解平衡常数的计算等知识,D为难点,注意掌握水解平衡常数的表达式及计算方法.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| … | W | |||
| X | Y | … | Z |
| A. | X、Y、Z、W的原子半径依次减小 | |
| B. | W与X形成的化合物中只含有离子键 | |
| C. | 气态氢化物的稳定性:W>Z | |
| D. | W与Y形成的化合物可分别与NaOH溶液和盐酸反应 |
①单位时间内生成nmolO2的同时生成2nmolNO2
②混合气体的平均相对分子质量不再改变
③NO2、NO、O2的反应速率之比为2:2:1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变.
| A. | ①②④ | B. | ②③⑤ | C. | ①②⑤ | D. | ②④⑤ |
| A. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| B. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| C. | 滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 | |
| D. | 称量时,称量放在称量瓶中,置于托盘天平的左盘,砝码放在托盘的天平的右盘中 |
2H2(g)+O2(g)=2H2O(l)△H=-572kJ•mol-1
H2(g)+0.5O2(g)=H2O(g)△H=-242kJ•mol-1
现有1mol液态水,蒸发时吸收的热量是( )
| A. | 2.44 kJ | B. | 44 kJ | C. | 88 kJ | D. | 330 kJ |
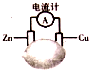
| A. | 锌片溶解了65g | B. | 电子由锌片流出 | ||
| C. | 铜片是负极 | D. | 锌片上发生氧化反应 |
| A. | 在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+=I2+O2↑+2H2O | |
| B. | 自然界中正常的雨水呈酸性:H2O+CO2?H2CO3?H++HCO3- | |
| C. | 将1mol/L NaAlO2溶液和1mol/L的H2SO4溶液等体积均匀混合:3AlO2-+6H+=2Al(OH)3↓+Al3+ | |
| D. | 向明矾溶液中滴加氢氧化钡溶液至SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |
 | ⅠA | 0族 | ||||||
| 一 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 二 | ② | ③ | ||||||
| 三 | ④ | ⑤ | ⑥ | |||||
(2)写出①单质在⑥单质中燃烧的化学方程式H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl.
(3)①②③三种元素能够形成多种有机化合物,其中一种不仅是厨房调味剂而且还能除去水垢.写出此物质的结构式:CH3COOH;写出该物质与NaHCO3反应的化学方程式:CH3COOH+NaHCO3→CH3COONa+H2O+CO2↑.

 .
. .
. .
. .
.