题目内容
16.如表是元素周期表的一部分,针对表中的①~⑥元素,回答下列问题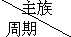 | ⅠA | 0族 | ||||||
| 一 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 二 | ② | ③ | ||||||
| 三 | ④ | ⑤ | ⑥ | |||||
(2)写出①单质在⑥单质中燃烧的化学方程式H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl.
(3)①②③三种元素能够形成多种有机化合物,其中一种不仅是厨房调味剂而且还能除去水垢.写出此物质的结构式:CH3COOH;写出该物质与NaHCO3反应的化学方程式:CH3COOH+NaHCO3→CH3COONa+H2O+CO2↑.
分析 由元素在周期表中位置,可知①为H、②为C、③为O、④为Na、⑤为Si、⑥为Cl.
(1)同周期自左而右元素金属性减弱、同主族自上而下元素金属性增强;同主族自上而下原子半径增大;元素非金属性越强,最高价含氧酸的酸性越强;
(2)氢气在氯气中燃烧生成HCl;
(3)①②③三种元素形成一种有机化合物不仅是厨房调味剂而且还能除去水垢,该有机物为乙酸,与碳酸氢钠反应生成乙酸钠、二氧化碳与水.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为O、④为Na、⑤为Si、⑥为Cl.
(1)同周期自左而右元素金属性减弱、同主族自上而下元素金属性增强,故上述元素中Na的金属性最强;同主族自上而下原子半径增大,故原子半径Si>C;非金属性Si<Cl,元素非金属性越强,最高价含氧酸的酸性越强,故高氯酸淀粉酸性更强,故答案为:Na;Si;Cl;
(2)氢气在氯气中燃烧生成HCl,反应方程式为:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,故答案为:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl;
(3)①②③三种元素形成一种有机化合物不仅是厨房调味剂而且还能除去水垢,该有机物为CH3COOH,与碳酸氢钠反应生成乙酸钠、二氧化碳与水,反应方程式为:CH3COOH+NaHCO3→CH3COONa+H2O+CO2↑,
故答案为:CH3COOH;CH3COOH+NaHCO3→CH3COONa+H2O+CO2↑.
点评 本题考查元素周期表与元素周期律,注意对元素周期表的整体把握,侧重对基础知识的巩固.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
9.实验室用纯溴和苯在铁离子催化下反应制取溴苯,得到粗溴苯后,要用如下操作精制,正确的操作顺序是
①蒸馏 ②水洗分液 ③用干燥剂干燥 ④10%NaOH溶液洗分液( )
①蒸馏 ②水洗分液 ③用干燥剂干燥 ④10%NaOH溶液洗分液( )
| A. | ①②③④② | B. | ②④②③① | C. | ④②③①② | D. | ②④①②③ |
7.在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )

| A. | a点Kw=1.0×10-14 mol2•L-2 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | b点:C(NH4+)>C(Cl-)>C(H+)>C(OH-) | |
| D. | 25℃时NH4Cl水解常数为(n-1)×10-7 mol•L-1(用n表示) |
4.下列说法正确的是( )
| A. | CaO、H2SO4、NaHCO3、碘酒均属于化合物 | |
| B. | 胶体与溶液的本质区别在于是否产生丁达尔效应 | |
| C. | 合金具有良好的物理、化学和机械性能,熔点比成分金属低 | |
| D. | 计算机芯片、太阳能电池、石英钟表主要材料均为SiO2 |
11.下列有关化学用语表示正确的是( )
| A. | 乙酸的结构简式为:C2H4O2 | B. | F-的结构示意图为: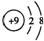 | ||
| C. | 中子数为17的氯原子:${\;}_{17}^{37}$CI | D. | NH3的电子式为: |
1.下列叙述中正确的是( )
| A. | 冰融化时水分子中共价键发生断裂 | |
| B. | H2O2、PCl5都是含有极性键的非极性分子 | |
| C. | HF、HCl、HBr、HI的酸性依次增强 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
8.化学是以实验为基础的自然科学,化学实验设计和操作中必须十分重视师生安全问题和环境保护问题.下列实验问题处理方法正确的是( )
| A. | 制氧气时排水法收集氧气后出现倒吸现象,应立即停止加热 | |
| B. | 在气体发生装置上直接点燃乙炔气体时,不需先检验乙炔气体的纯度 | |
| C. | 白磷在空气中易自燃,用剩的白磷可溶解于CS2后倒入垃圾箱 | |
| D. | 给试管中的液体加热时,可加入碎瓷片或不时移动试管,以免暴沸伤人 |
5. 某校课外实验小组同学设计了如图装置制取并收集一瓶气体,请帮助该小组同学完成下表.
某校课外实验小组同学设计了如图装置制取并收集一瓶气体,请帮助该小组同学完成下表.
 某校课外实验小组同学设计了如图装置制取并收集一瓶气体,请帮助该小组同学完成下表.
某校课外实验小组同学设计了如图装置制取并收集一瓶气体,请帮助该小组同学完成下表.| 制取的气体 | 药 品 | 化学方程式 |
| O2 | H2O2、MnO2 | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑ |
| H2 | 乙醇、Na | 2CH2CH2OH+2Na=2CH3CH2ONa+H2↑ |
6.已知25℃时,BaCO3的溶度积Ksp=2.58×10-9,BaSO4的溶度积Ksp=1.07×10-10,则下列说法不正确的是( )
| A. | 温度一定时,当溶液中c(Ba2+)×c(SO42-)=1.07×10-10时,此溶液为BaSO4的饱和溶液 | |
| B. | 因为Ksp(BaCO3)>Ksp(BaSO4),所以无法将BaSO4转化为BaCO3 | |
| C. | 25℃时,在未溶解完BaCO3的饱和溶液中滴入少量Na2SO4溶液后有BaSO4沉淀析出,此时溶液中c(CO32-):c(SO42-)=24.11 | |
| D. | 在饱和BaCO3溶液中加入少量Na2CO3固体,可使c(Ba2+)减小,BaCO3的溶度积不变 |