题目内容
2.已知:2H2(g)+O2(g)=2H2O(l)△H=-572kJ•mol-1
H2(g)+0.5O2(g)=H2O(g)△H=-242kJ•mol-1
现有1mol液态水,蒸发时吸收的热量是( )
| A. | 2.44 kJ | B. | 44 kJ | C. | 88 kJ | D. | 330 kJ |
分析 ①2H2(g)+O2(g)=2H2O(l)△H=-572kJ•mol-1 ,变化为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ•mol-1 ,
②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-242kJ•mol-1
根据盖斯定律和热化学方程式计算得到所需热化学方程式得到蒸发时吸收的热量.
解答 解:依据热化学方程式①2H2(g)+O2(g)=2H2O(l)△H=-572kJ•mol-1 ,变化为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ•mol-1 ,
②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-242kJ•mol-1
结合盖斯定律②-①得到1mol液态水,蒸发时吸收的热量,H2O(l)=H2O(g)△H=44kJ•mol-1
故选B.
点评 本题考查了热化学方程式书写,盖斯定律计算应用,主要是对应焓变的分析计算,掌握基础是关键,题目较简单.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
15.下列反应中属于取代反应的是( )
| A. | 乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 苯与氢气在一定条件下反应生成环己烷 | |
| C. | 苯与浓硝酸和浓硫酸的混合液反应生成油状液体 | |
| D. | 乙烯与溴的四氯化碳溶液反应 |
13.下列指定反应的离子方程式正确的是( )
| A. | 用氨水吸收足量的SO2:0H-+S02═HS03- | |
| B. | 氢氧化钡溶液与硫酸氢钠溶液反应至恰好呈中性:Ba2++2H++SO42-+20H-═BaS04↓+2H20 | |
| C. | 在加热条件下浓盐酸与Mn02反应制取少量氯气:Mn02+2H++2Cl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H20 | |
| D. | 向一定量的FeBr2溶液中通入过量Cl2:2Fe2++Cl2═2Fe3++2Cl- |
20.中国古代四大发明之一的黑火药,它的爆炸反应为:S+2KNO3+3C═K2S+N2↑+3CO2↑,当发生上述反应时,2molKNO3可氧化木炭的物质的量是( )
| A. | 3mol | B. | 2.5mol | C. | 1mol | D. | 0.5mol |
7.在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )

| A. | a点Kw=1.0×10-14 mol2•L-2 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | b点:C(NH4+)>C(Cl-)>C(H+)>C(OH-) | |
| D. | 25℃时NH4Cl水解常数为(n-1)×10-7 mol•L-1(用n表示) |
14.下表是元素周期表示意图的一部分,根据A~I在元素周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素化学性质最不活泼的是Ne,只有负化合价而无正化合价的是F,非金属性最强的元素是F,金属性最强的元素是Na.
(2)表中元素最高价氧化物的水化物的碱性最强的化合物是NaOH,酸性最强的化合物是HClO4,呈两性的化合物是Al(OH)3.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的是HF.
| 周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)表中元素最高价氧化物的水化物的碱性最强的化合物是NaOH,酸性最强的化合物是HClO4,呈两性的化合物是Al(OH)3.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的是HF.
11.下列有关化学用语表示正确的是( )
| A. | 乙酸的结构简式为:C2H4O2 | B. | F-的结构示意图为: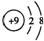 | ||
| C. | 中子数为17的氯原子:${\;}_{17}^{37}$CI | D. | NH3的电子式为: |

 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.