题目内容
13. 工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:| 化学反应 | 平衡 常数 | 温度/℃ | ||
| 500 | 700 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.34 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 1.70 | 2.52 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | |||
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”、“=”或“<”).
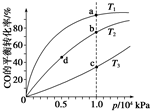
(4)反应①按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是CD(填序号).
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
D.平均摩尔质量:M(a)>M(c),M(b)>M(d)
分析 (1)依据反应②的平衡常数随温度变化判断反应能量变化;
(2)平衡常数是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,结合反应①+②得到反应③,可得平衡常数K3=K1×K2;
(3)计算浓度商和平衡常数比较分析判断反应进行方向;
(4)依据影响化学反应速率的因素和影响平衡移动的因素及根据平均摩尔质量=$\frac{总质量}{总物质的量}$进行判断.
解答 解:(1)反应②CO2(g)+H2(g)?CO(g)+H2O(g)的平衡常数随温度升高增大,说明平衡正向进行,正反应是吸热反应;
故答案为:吸热;
(2)平衡常数是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,结合反应①+②得到反应③,可得平衡常数K3=K1•K2;
故答案为:K1•K2;
(3)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol•L-1、0.8mol•L-1、0.3mol•L-1、0.15mol•L-1,Q=$\frac{0.3×0.15}{0.{8}^{3}×0.1}$=0.88<K=2.5,则此时v正>v逆;
故答案为:>;
(4)A.根据反应①中温度与K的关系,可推断该反应为放热反应,升温,平衡左移,CO的转化率减小,所以T3>T2>T1,A错误;
B.反应速率v(c)>v(a),v(b)>v(d),B错误;
C.温度越高,平衡常数越小,压强对平衡常数无影响,所以K(a)>K(c),K(b)=K(d),C正确;
D.升温,平衡左移,平均摩尔质量减小,加压,平衡右移,平均摩尔质量增大,所以M(a)>M(c),M(b)>M(d),D正确,
故选CD.
点评 本题考查了化学平衡、反应速率影响因素分析判断,平衡常数计算应用,掌握反应特征和平衡移动原理是关键,题目难度中等.

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案| A. | 它们单质的熔、沸点随核电荷数的增加逐渐降低 | |
| B. | 元素的非金属性随核电荷数的增加逐渐减小 | |
| C. | 它们原子的氧化性随核电荷数的增加逐渐增强 | |
| D. | 它们氢化物的稳定性随核电荷数的增加逐渐增强 |
| A. | 反应物浓度减小,反应速率减小 | |
| B. | 反应物浓度增加,反应速率增加 | |
| C. | 温度升高,反应速率增加 | |
| D. | 热水对反应起催化作用,从而加快了反应速率 |
| 类比对象 | 结论 | |
| A | Cl2+H2O$\frac{\underline{\;\;△\;\;}}{\;}$HCl+HClO | I2+H2O$\frac{\underline{\;\;△\;\;}}{\;}$HI+HIO |
| B | C+2CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+CO2↑ | C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ |
| C | Na2O+H2O=2NaOH | CuO+H2O=Cu(OH)2 |
| D | Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO | Ca(ClO)2+SO2+H2O=CaSO3↓+2HClO |
| A. | A | B. | B | C. | C | D. | D |
| A. | 浓硫酸具有脱水性 | B. | 浓硫酸具有吸水性 | ||
| C. | 盐酸具有挥发性 | D. | 气体的溶解度的随温度升高而降低 |
| A. | 它能使酚酞试液变红色 | |
| B. | 氨水极易挥发出氨 | |
| C. | 氨与水结合生成的一水合氨(NH3•H2O)只有小部分电离成NH4+和OH- | |
| D. | 溶于水的氨大部分以NH3分子形式存在 |
| A. | 该化合物仅含碳、氢两种元素 | B. | 该化合物中碳、氢原子个数比为1:4 | ||
| C. | 无法确定该化合物是否含有氧元素 | D. | 此有机物的最简式为CH4O |

| A. | 图1所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 | |
| B. | 图2所示装置用于除去碳酸氢钠固体中的少量碳酸钠 | |
| C. | 图3所示装置配制100mL0.1mol•L-1的硫酸 | |
| D. | 图4所示装置用于分离出溴苯 |