题目内容
1.类比推理是化学学习中的一种重要方法.下列类推结论正确的是( )| 类比对象 | 结论 | |
| A | Cl2+H2O$\frac{\underline{\;\;△\;\;}}{\;}$HCl+HClO | I2+H2O$\frac{\underline{\;\;△\;\;}}{\;}$HI+HIO |
| B | C+2CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+CO2↑ | C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ |
| C | Na2O+H2O=2NaOH | CuO+H2O=Cu(OH)2 |
| D | Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO | Ca(ClO)2+SO2+H2O=CaSO3↓+2HClO |
| A. | A | B. | B | C. | C | D. | D |
分析 A.卤素单质和水发生歧化反应生成氢卤酸和次卤酸;
B.C和金属氧化物发生氧化还原反应,也能和二氧化碳发生氧化还原反应;
C.CuO和水不反应;
D.二氧化硫具有还原性、次氯酸钙具有强氧化性,二者发生氧化还原反应.
解答 解:A.Cl、I在同一主族,单质的性质相似,所以由Cl2+H2O?HCl+HClO可知,I2+H2O?HI+HIO,故A正确;
B.C具有还原性,与金属氧化物发生氧化还原反应,且C与二氧化碳反应,则应为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,故B错误;
C.CuO不溶于水,不能与水反应,而Na2O+H2O═2NaOH,金属氧化物的性质不同,故C错误;
D.Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO为强酸制取弱酸的反应,但二氧化硫具有还原性,次氯酸钙有强氧化性,二者发生氧化还原反应Ca(ClO)2+2SO2+2H2O═CaSO4↓+2HCl+H2SO4,故D错误;
故选A.
点评 本题考查物质的性质,侧重考查元素化合物之间的反应,涉及卤族元素、金属氧化物、非金属氧化物等物质,注意碳和二氧化硅反应产物是CO而不是二氧化碳,易错选项是BD.

练习册系列答案
相关题目
11.下列除去杂质的方法正确的是:( )
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去苯中混有的少量苯酚:加入浓溴水后过滤取滤液;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去苯中混有的少量苯酚:加入浓溴水后过滤取滤液;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
12.扑灭钾.钠的火焰,可选用下列物质中的( )
| A. | 水 | B. | 二氧化碳 | C. | 沙子 | D. | 干冰 |
9.下列说法错误的是( )
| A. | 含有离子键的化合物一定是离子化合物 | |
| B. | 共价化合物中一定没有离子键 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 双原子单质分子中的共价键一定是非极性键 |
16.由下列实验事实得出的结论正确的是( )
| 实验事实 | 结论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | 将SO2通入Ba(NO3)2溶液,有白色沉淀生成 | BaSO3难溶于硝酸 |
| C | Na2SiO3溶液中通CO2气体出现浑浊 | 酸性:H2SiO3<H2CO3 |
| D | 浓硫酸使蔗糖变黑 | 浓硫酸有脱水性 |
| A. | A | B. | B | C. | C | D. | D |
6.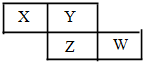 X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如下图所示.若Y原子的最外层电子是 k层电子数的3倍,下列说法不正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如下图所示.若Y原子的最外层电子是 k层电子数的3倍,下列说法不正确的是( )
 X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如下图所示.若Y原子的最外层电子是 k层电子数的3倍,下列说法不正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如下图所示.若Y原子的最外层电子是 k层电子数的3倍,下列说法不正确的是( )| A. | 氢化物的熔、沸点:H2Y>H2Z | |
| B. | 元素X、Z的最高价氧化物对应的水化物都是强酸 | |
| C. | W元素的阴离子与Ar原子具有相同的电子层结构 | |
| D. | X与Y形成的化合物都易溶于水 |
13. 工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
请回答下列问题:
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”、“=”或“<”).
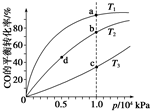
(4)反应①按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是CD(填序号).
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
D.平均摩尔质量:M(a)>M(c),M(b)>M(d)
 工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:| 化学反应 | 平衡 常数 | 温度/℃ | ||
| 500 | 700 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.34 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 1.70 | 2.52 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | |||
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”、“=”或“<”).
(4)反应①按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是CD(填序号).
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
D.平均摩尔质量:M(a)>M(c),M(b)>M(d)
10.下列关于元素周期表的说法正确的是( )
| A. | 元素周期表共有七个周期 | |
| B. | 元素周期表共有18个族 | |
| C. | 所含元素种数最多的族是 VIII族 | |
| D. | 第三周期元素的原子核外都有三个电子层 |
6. 醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
i.2CH3OH(g)?CH3OCH3(g)+H2O(g)
ii.2CH3OH(g)?C2H4(g)+2H2O(g)
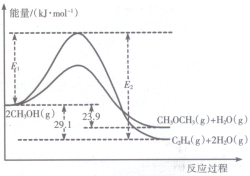
I.上述反应过程中能量变化如图所示:
(1)在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应,反应i(填“i”或“ii”)的速率较大,其原因为该反应的活化能较小.若在容器中加入催化剂,使ii的反应速率增大,则E1和E2-E1的变化是:E1减小;E2-E1不变(填“增大”、“减小”或“不变”).
(2)已知:CH3CH2OH(g)=CH3OCH3(g)△H=+50.7kJ.mol-1.则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的△H=-45.5kJ•mol-1.
Ⅱ,某研究小组通过控制反应条件,在三个容积均为2L的密闭容器中只发生反应i,起始反应温度均为T℃,起始投料如下表所示:
(3)比较平衡时容器1中c1(H2O)和容器2中c2(H2O)的大小:c1(H2O)<c2(H2O)(填“>”、“<”或“=”);三个容器中反应的化学平衡常数分别记为K1、K2和K3,三者的大小关系为K1=K2>K3.
(4)若容器l中平衡时CH3OH(g) 的转化率为80%,则该温度下反应i的平衡常数K=4.
 醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:i.2CH3OH(g)?CH3OCH3(g)+H2O(g)
ii.2CH3OH(g)?C2H4(g)+2H2O(g)
I.上述反应过程中能量变化如图所示:
(1)在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应,反应i(填“i”或“ii”)的速率较大,其原因为该反应的活化能较小.若在容器中加入催化剂,使ii的反应速率增大,则E1和E2-E1的变化是:E1减小;E2-E1不变(填“增大”、“减小”或“不变”).
(2)已知:CH3CH2OH(g)=CH3OCH3(g)△H=+50.7kJ.mol-1.则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的△H=-45.5kJ•mol-1.
Ⅱ,某研究小组通过控制反应条件,在三个容积均为2L的密闭容器中只发生反应i,起始反应温度均为T℃,起始投料如下表所示:
| 起始投料/mol 编号 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 恒温容器1 | 2 | 0 | 0 |
| 恒温容器2 | 0 | 2 | 2 |
| 绝热容器3 | 2 | 0 | 0 |
(4)若容器l中平衡时CH3OH(g) 的转化率为80%,则该温度下反应i的平衡常数K=4.