题目内容
3.下列关于卤族元素的说法中正确的是( )| A. | 它们单质的熔、沸点随核电荷数的增加逐渐降低 | |
| B. | 元素的非金属性随核电荷数的增加逐渐减小 | |
| C. | 它们原子的氧化性随核电荷数的增加逐渐增强 | |
| D. | 它们氢化物的稳定性随核电荷数的增加逐渐增强 |
分析 A.卤素单质的熔沸点随着核电荷数增大而升高;
B.元素的非金属性随着核电荷数增大而减弱;
C.元素的非金属性越强,其氧化性越强;
D.元素的非金属性越强,其氢化物的稳定性越强.
解答 解:A.卤素单质都是分子晶体,其单质的熔沸点与相对分子质量成正比,卤素单质的相对分子质量随着原子序数增大而增大,所以卤素单质的熔沸点随着核电荷数增大而升高,故A错误;
B.随着原子电子层数增多,原子核对最外层电子的吸引力减小,所以元素的非金属性随着核电荷数增大而减弱,故B正确;
C.元素的非金属性越强,其氧化性越强,元素的非金属性随着原子序数增大而减小,所以其氧化性随着原子序数增大而减小,故C错误;
D.元素的非金属性随着原子序数增大而减小,所以其氢化物的稳定性随着原子序数增大而减弱,故D错误;
故选B.
点评 本题考查元素周期律的应用,明确同一主族元素原子结构、性质递变规律即可解答,熟练掌握元素周期律知识并灵活运用,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
14.X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的三倍.有关下列叙述正确的是( )
| A. | X、Y、Z三种元素可形成化合物X3YZ4 | |
| B. | X、Y两元素形成的化合物只可能为离子化合物 | |
| C. | Y、Z两元素形成的化合物均会对空气造成污染 | |
| D. | 稳定性:Y的氢化物大于Z的氢化物 |
11.下列除去杂质的方法正确的是:( )
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去苯中混有的少量苯酚:加入浓溴水后过滤取滤液;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去苯中混有的少量苯酚:加入浓溴水后过滤取滤液;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
18.下列叙述中,不正确的是( )
| A. | 共价化合物中不可能含有离子键 | |
| B. | 硫酸分子中有H+和SO42-两种离子 | |
| C. | 某元素原子的最外层只有一个电子,它跟卤素可能形成离子键,也可能形成共价键 | |
| D. | 离子键和共价键的实质都是电性的相互作用 |
15.下列各组均有两种有机物,若分别取相同的物质的量,在足量的氧气中完全燃烧,两种有机物耗氧量不相同的是( )
| A. | 乙烯和乙醇 | B. | 苯酚和苯甲醇 | C. | 甲烷和乙酸 | D. | 乙炔和乙醛 |
12.扑灭钾.钠的火焰,可选用下列物质中的( )
| A. | 水 | B. | 二氧化碳 | C. | 沙子 | D. | 干冰 |
13. 工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
请回答下列问题:
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”、“=”或“<”).
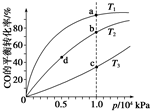
(4)反应①按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是CD(填序号).
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
D.平均摩尔质量:M(a)>M(c),M(b)>M(d)
 工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:| 化学反应 | 平衡 常数 | 温度/℃ | ||
| 500 | 700 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.34 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 1.70 | 2.52 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | |||
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”、“=”或“<”).
(4)反应①按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是CD(填序号).
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
D.平均摩尔质量:M(a)>M(c),M(b)>M(d)