题目内容
【题目】乙烯是重要的化工原料,以乙烯为原料在不同条件下可合成下列物质(部分条件未标出):乙烯![]() A
A![]() 乙醇
乙醇![]() 乙醛
乙醛![]() 乙酸。按下列要求写出:
乙酸。按下列要求写出:
(1)乙醇中含氧官能团名称为________,乙酸中含氧官能团名称为________
(2)写出下列反应方程式:
反应:____________
反应④:____________
(3)反应④的实验现象为:___________。实验室常用银氨溶液检验乙醛,所需用的实试剂2%硝酸银溶液和2%稀氨水;银氨溶液配制的方法是:______
(4)反应为乙醇与氧气在加热及Cu催化条件下反应生成乙醛,依次写出反应中铜丝由红变黑,再由黑变红过程中的化学方程式:__________、_______。
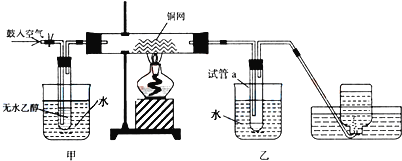
(5)若用如图所示装置试管a中收集乙醇催化氧化的产物:
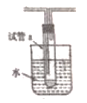
①水浴的作用为_______________,用姿色石蕊试纸检验收集的产物,试纸显红色,说明液体中还含有__________。
②要除去该物质,可在混合液中加入______(填写字母)
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过________(填实验操作名称)即可除去。
【答案】羟基 羧基 CH3CH2Cl+NaOH![]() CH3CH2OH+NaCl CH3CHO+2Cu(OH)2
CH3CH2OH+NaCl CH3CHO+2Cu(OH)2![]() CH3COOH+Cu2O↓+2H2O 原来蓝色的氢氧化铜悬浊液转化为砖红色的氧化亚铜沉淀 在洁净的试管里加入1 mL 2%的硝酸银溶液,然后,一边摇动试管,一边逐滴滴加2%的稀氨水,直到最初产生的沉淀恰好溶解为止,制得银氨溶液 2Cu + O2
CH3COOH+Cu2O↓+2H2O 原来蓝色的氢氧化铜悬浊液转化为砖红色的氧化亚铜沉淀 在洁净的试管里加入1 mL 2%的硝酸银溶液,然后,一边摇动试管,一边逐滴滴加2%的稀氨水,直到最初产生的沉淀恰好溶解为止,制得银氨溶液 2Cu + O2 ![]() 2CuO CH3CH2OH+CuO
2CuO CH3CH2OH+CuO![]() CH3CHO+Cu+H2O 加热乙醇,便于乙醇的挥发 乙酸 c 蒸馏
CH3CHO+Cu+H2O 加热乙醇,便于乙醇的挥发 乙酸 c 蒸馏
【解析】
乙烯与HCl发生加成反应生成CH3CH2Cl,一氯乙烷在氢氧化钠水溶液加热的条件下发生取代反应生成乙醇,乙醇被催化氧化生成乙醛,乙醛再与新制氢氧化铜悬浊液反应得到乙酸。
(1)乙醇中含氧官能团为羟基,乙酸中含氧官能团为羧基;
(2)反应为一氯乙烷的取代反应,方程式为:CH3CH2Cl+NaOH![]() CH3CH2OH+NaCl;
CH3CH2OH+NaCl;
反应④为醛基的氧化反应,方程式为:CH3CHO+2Cu(OH)2![]() CH3COOH+Cu2O↓+2H2O;
CH3COOH+Cu2O↓+2H2O;
(3)反应中可以观察到原来蓝色的氢氧化铜悬浊液转化为砖红色的氧化亚铜沉淀;银氨溶液的配制方法为:在洁净的试管里加入1 mL 2%的硝酸银溶液,然后一边摇动试管,一边逐滴滴加2%的稀氨水,直到最初产生的沉淀恰好溶解为止,制得银氨溶液;
(4)反应中铜丝由红变黑,再由黑变红过程中的化学方程式为:2Cu + O2 ![]() 2CuO、CH3CH2OH+CuO
2CuO、CH3CH2OH+CuO![]() CH3CHO+Cu+H2O;
CH3CHO+Cu+H2O;
(5)①水浴使温度升高,加热乙醇,便于乙醇的挥发;紫色石蕊试纸变蓝说明收集到的产物为酸性物质,结合反应物可知其为乙酸;
②乙酸为一种弱酸可以和碳酸氢钠发生反应,且碳酸氢钠不与乙醛反应,可用碳酸氢钠溶液与乙酸反应生成乙酸钠,之后通过蒸馏除去,所以选c。

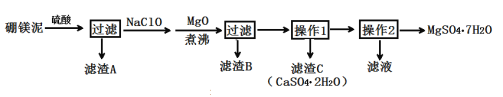
【题目】七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上有重要的用途。硼镁泥是硼镁矿生产硼砂的废渣,其主要成分是MgCO3,还含有MgO、CaO、Fe2O3、FeO、MnO2、Al2O3、SiO2等杂质,工业上用硼镁泥制取七水硫酸镁的工艺流程如图:
已知:①MnO2不溶于稀硫酸。
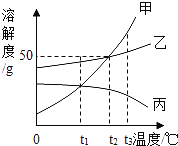
②CaSO4和MgSO4·7H2O在不同温度下的溶解度(g)数据如下表所示:
温度/℃ 物质 | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.21 | 0.19 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | —— |
(1)开始用到硫酸的质量分数为70%,密度为1.61g/cm3,则该硫酸溶液的物质的量浓度为___。
(2)滤渣A中除含少量CaSO4·2H2O外,还有___。
(3)加入MgO后,加热煮沸的目的是___。
(4)若滤渣B的主要成分为Al(OH)3和Fe(OH)3。则加入NaClO发生氧化还原反应的离子方程式为___。
(5)流程中操作1为蒸发浓缩、趁热过滤,这样即可得到CaSO4·2H2O,又防止___。
(6)获取MgSO4·7H2O的操作2为:___、___、过滤洗涤。
(7)已知开始硼镁泥样品的质量为ag,制取七水硫酸镁的质量为bg,据此能计算出硼镁泥中镁元素的含量吗?若能,请写出表达式;若不能,请说明理由。___(能或不能),表达式(或理由)为___。