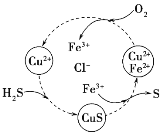
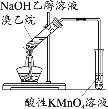
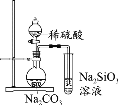
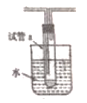
题目内容
【题目】用标准氢氧化钠溶液(浓度为0.2812mol/L)测定未知浓度的盐酸溶液。
(1)写出化学方程式:____________
(2)滴定时可用_________作指示剂,当溶液由___色变成___色,且0.5min不褪时达到滴定终点。
(3)取20.00mL待测盐酸溶液,滴定终点时,消耗标准氢氧化钠30.00mL,待测盐酸溶液的浓度为________
【答案】NaOH+HCl=NaCl+H2O 酚酞 无 粉红 0.4218 mol/L
【解析】
(1)氢氧化钠与盐酸反应生成氯化钠和水;
(2)强碱滴定强酸,反应后呈中性,可用酚酞为指示剂,滴定终点,溶液颜色由无色变为浅红色;
(3)酸碱恰好完全反应,满足c(酸)V(酸)=c(碱)V(碱),以此计算。
(1)氢氧化钠与盐酸反应生成氯化钠和水,化学方程式为:NaOH+HCl=NaCl+H2O;
(2)氢氧化钠滴定盐酸,根据滴定终点氢氧化钠的显色用酚酞较合适,酸碱恰好中和时,溶液颜色由无色变为浅红色,且0.5min不褪时证明达到滴定终点;
(3)根据c(酸)V(酸)=c(碱)V(碱),c(酸)=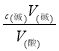 =
=![]() =0.4218 mol/L。
=0.4218 mol/L。

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目