题目内容
【题目】二十世纪初德国化学家哈伯和工程师博施成功地开发了合成氨的生产工艺,为社会的发展和进步做出了重大贡献。如今科学家为提高氨的产量,以及对各种氨的化合物的研究仍做着各种有益的探索。试回答下列问题:
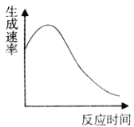
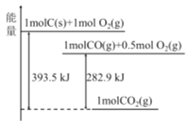
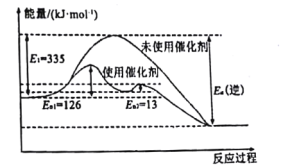
(1)N2(g)+3H2(g)![]() 2NH3(g) △H =-92.4kJ·mol-1如图所示,合成氨反应中未使用催化剂时,逆反应的活化能Ea(逆)=___kJ·mol-1。
2NH3(g) △H =-92.4kJ·mol-1如图所示,合成氨反应中未使用催化剂时,逆反应的活化能Ea(逆)=___kJ·mol-1。
(2)①在一定条件下,分别将lmolN2和3molH2置于容积恒定的密闭容器中,达化学平衡状态时,NH3的体积分数为10%,若保持其他条件不变,起始时改为充入2molN2和2molH2,达新平衡后,NH3的体积分数为___10%(填“>”、“<”或“=”)。
②某温度下,n(N2):n(H2)=1:3的混合气体在刚性容器内发生反应,起始时气体总压为p0Pa,平衡时气体总压为0.9p0Pa,气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学反应平衡常数(记作Kp),则此温度下,该反应的化学平衡常数Kp=___(用含p0的代数式表示)。
(3)合成氨需要的H2来源比较广泛,氢气的储存制备等问题也日益得到解决。在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)![]() MHx+2y(s)△H<0达到化学平衡。下列有关叙述正确的是(______)
MHx+2y(s)△H<0达到化学平衡。下列有关叙述正确的是(______)
a.容器内气体压强保持不变
b.吸收ymolH2需1molMHx
c.若向容器内通入少量氢气,新平衡后c(H2)比原平衡大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
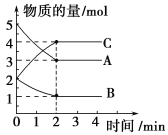
(4)利用现代手持技术传感器可以探究压强对化学平衡移动的影响,如以2NO2(g)![]() N2O4(g)为例。在恒定温度和标准压强(100kPa)条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变(不考虑温度的变化)。测定针筒内气体压强变化如图所示:
N2O4(g)为例。在恒定温度和标准压强(100kPa)条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变(不考虑温度的变化)。测定针筒内气体压强变化如图所示:
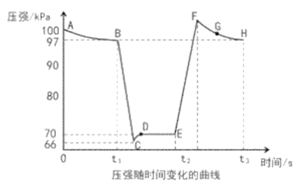
①B、E两点对应的正反应速率大小为vB___vE(填“>”、“<”或“=”)。
②E、F、G、H四点时对应气体的平均相对分子质量最大的点为___。
(5)NH3能够和Ag+形成Ag(NH3)2+,溶液中存在Ag+(aq)+2NH3(aq)![]() Ag(NH3)2+(aq)常温下,K[Ag(NH3)2+]=1.10×107,反应AgCl(s)+2NH3(aq)
Ag(NH3)2+(aq)常温下,K[Ag(NH3)2+]=1.10×107,反应AgCl(s)+2NH3(aq)![]() Ag(NH3)2(aq)++Cl-(aq)的化学平衡常数K=1.936×10-3,则Ksp(AgCl)=___。
Ag(NH3)2(aq)++Cl-(aq)的化学平衡常数K=1.936×10-3,则Ksp(AgCl)=___。
【答案】427.4 < ![]() a > H 1.76×10-10
a > H 1.76×10-10
【解析】
(4)据图可知t1时刻压强瞬间减小,此时应为拉动活塞使体积增大,压强减小,该反应为气体体积减小的反应,所以平衡逆向移动,即C到D的变化;t2时刻压强瞬间增大压强瞬间变大,可知此时应为推动活塞压缩体积,由于该反应为气体体积减小的反应,所以加压平衡正向移动,即F到H的变化。
(1)焓变=正反应活化能-逆反应活化能,所以有-92.4kJ·mol-1=335 kJ·mol-1- Ea(逆),可得Ea(逆)=427.4 kJ·mol-1;
(2)①氮气和氢气合成氨的方程式为N2(g)+3H2(g)![]() 2NH3(g),一定条件下,对于可逆反应当反应物投料比等于计量数之比时,生成物的体积分数达到最大,1molN2和3molH2反应NH3的体积分数为10%,则2molN2和2molH2,达新平衡后,NH3的体积分数小于10%;
2NH3(g),一定条件下,对于可逆反应当反应物投料比等于计量数之比时,生成物的体积分数达到最大,1molN2和3molH2反应NH3的体积分数为10%,则2molN2和2molH2,达新平衡后,NH3的体积分数小于10%;
②不妨设初始投料为1molN2和3molH2,设△n(N2)=x,列三段式有:
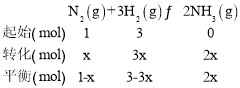
恒容密闭容器中压强比气体的物质的量之比,所以![]() =
=![]() ,解得x=0.2mol,所以平衡时n(N2)=0.8mol,n(H2)=2.4mol,n(NH3)=0.4mol,则p(N2)=
,解得x=0.2mol,所以平衡时n(N2)=0.8mol,n(H2)=2.4mol,n(NH3)=0.4mol,则p(N2)=![]() =0.2p0,同理可得p(H2)=0.6p0,p(NH3)=0.1p0,则Kp=
=0.2p0,同理可得p(H2)=0.6p0,p(NH3)=0.1p0,则Kp=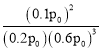 =
=![]() ;
;
(3)a.该反应前后气体系数之和不同,所以未达到平衡时容器压强会变,平衡后压强补在变化,故a正确;
b.该反应为可逆反应,所以1molMHx不能完全吸收y mol氢气,故b错误;
c.该反应平衡常数表达式为![]() ,温度不变平衡常数不变,则通入少量氢气后达到的新平衡体系中氢气的浓度不变,故c错误;
,温度不变平衡常数不变,则通入少量氢气后达到的新平衡体系中氢气的浓度不变,故c错误;
d.通入少量氢气平衡正向移动,即v(吸氢)>v(放氢),故d错误;
综上所述选a;
(4)①据图可知B点压强大于E点,该实验中是通过改变体积改变压强,所以B点容器体积比E点容器体积要小,浓度要大,所以vB>vE;
②气体平均相对分子质量等于气体总质量与气体总物质的量之比,气体总质量不变,所以气体的总物质的量越小,平均相对分子质量越大,平衡正向移动时气体的物质的量减小,根据分析可知C到D平衡逆向移动,D到E为平衡状态,F到H平衡正向移动,所以H点气体的总物质的量最小,即H点对应气体的平均相对分子质量最大;
(5)反应AgCl(s)+2NH3(aq)![]() Ag(NH3)2(aq)++Cl-(aq)的化学平衡常数K=
Ag(NH3)2(aq)++Cl-(aq)的化学平衡常数K=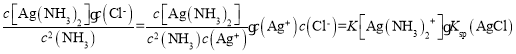 ,所以Ksp(AgCl)=
,所以Ksp(AgCl)=![]() =1.76 ×10-10。
=1.76 ×10-10。

 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案【题目】绪(Ge)是半导体元素,应用广泛,回答下列问题:
(1)下列为Ge价电子层电子排布图表示的状态中,能量最低和最高的分别为____、_____(填选项)。
A.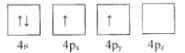 B.
B.
C.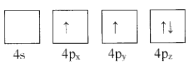 D.
D.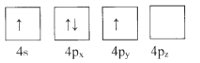
(2)GeH4的空间构型为____;比较与同锗族的氢化物的沸点如表所示,分析其变化规律及原因____。
CH4 | SiH4 | GeH4 | |
沸点/℃ | -161.5 | -119 | -88.1 |
(3)有机锗化合物A有一定的医疗保健作用,其结构简式为CF3N=GeH2,则Ge的杂化形式为____,碳原子与其它原子结合的键的种类为_____。
(4)Li2GeF6可以作为锂电池的电解质,则Li、Ge、F电负性由大到小的顺序为_____。
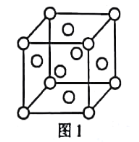
(5)Ge晶胞如下,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() ),D为(
),D为(![]() ,
,![]() ,
,![]() )。则C原子的坐标参数为_____。
)。则C原子的坐标参数为_____。
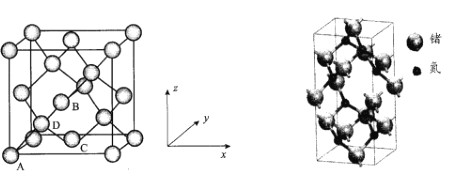
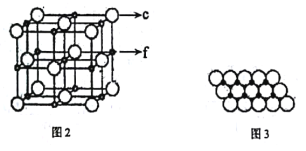
(6)氮化锗具有耐腐蚀、硬度高等优点,晶体中锗原子与氮原子之间存在明显的s-p杂化现象,氮化锗晶体属于____晶体。一种氮化锗晶胞的球棍模型如图,晶体中n(Ge)/n(N)=____,若晶胞底面正方形的边长为anm,阿伏加德罗常数值为NA,晶体的密度为ρg/cm3,则长方体的高为____nm(列出计算式)。