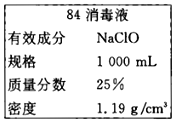
��Ŀ����
����Ŀ�����仯��������������������������ء�
��1����֪��S(s)+O2(g)= SO2(g) ��H1=-a kJ��mol-1
S(g)+O2(g)= SO2(g) ��H2=- b kJ��mol-1
��a___(�>����<��)b��
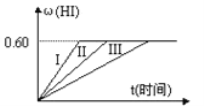
��2����һ���¶Ⱥ�ѹǿ�£���2molSO2��1molO2�����ܱ������з�����Ӧ��2SO2(g)+O2(g)![]() 2SO3(g)�����ﵽƽ�⡣
2SO3(g)�����ﵽƽ�⡣
�����ټ���1 molO2����ƽ����___(��������桱)��Ӧ�����ƶ���
���������¶ȣ��ﵽƽ��ʱ���SO2�ĺ������٣�������Ӧ��___(����ȡ����ȡ�)��Ӧ��
�۸÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK=___����ֻ����ѹǿ����K__(�������С�����䡱)��
��3�������£�����0.5mol��L-1Na2SO3��Һ�����жϣ�(Na2SO3��һ��ˮ������ӷ���ʽ��SO32-+H2O![]() HSO3-+OH-)
HSO3-+OH-)
�ٸ���Һ��pH___(�>����<��)7��
�ڸ���Һ��c(Na+)___(�>����<��)2c(SO32-)��
������ˮ�ⷴӦ�����ȷ�Ӧ�����ȸ���Һ��SO32-��Ũ�Ƚ�__(�����С��)��
��4����ͼ�ǵ������ͭ��Һ��װ�á�
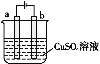
����a��bΪʯī�缫��b�缫���������ӣ�д���ü��ĵ缫��Ӧʽ��___��
�ڵ���ǵ��ԭ����һ����ҪӦ�á������ø�װ���������϶�ͭ��������Ӧ���Դ��__ (�������������)���ӡ�
��5����֪���ᱵ�ij����ܽ�ƽ��Ϊ��BaSO4(s)![]() Ba2+(aq)+SO42-(aq) Ksp=1.0��10-10�������ᱵ�ı�����Һ��Ba2+��Ũ��Ϊ____mol��L-1��
Ba2+(aq)+SO42-(aq) Ksp=1.0��10-10�������ᱵ�ı�����Һ��Ba2+��Ũ��Ϊ____mol��L-1��
���𰸡�< �� ���� ![]() ��
��![]() ���� > > ��С Cu2++2e-=Cu ���� 1.0��10-5
���� > > ��С Cu2++2e-=Cu ���� 1.0��10-5
��������
��1����֪����S(s)+O2(g)= SO2(g) ��H1=-a kJ��mol-1����S(g)+O2(g)= SO2(g)��H2=- b kJ��mol-1
��-���ã�S(s) = S(g) ��H=��-a+b��kJ��mol-1�����ɹ�̬��Ϊ��̬Ϊ���ȣ������H>0����-a+b>0����a<b��
����<��
��2����һ���¶Ⱥ�ѹǿ�£���2molSO2��1molO2�����ܱ������з�����Ӧ��2SO2(g)+O2(g)![]() 2SO3(g)�����ﵽƽ�⡣
2SO3(g)�����ﵽƽ�⡣
�����ټ���1 molO2���൱������������Ũ�ȣ���ƽ��������Ӧ�����ƶ���
��������
���������¶ȣ��ﵽƽ��ʱ���SO2�ĺ������٣�����Ӧ�������ƶ���������Ӧ�Ƿ��ȷ�Ӧ����Ϊ�����ȣ�
�۸÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK=![]() ��
��![]() ����ѧƽ�ⳣ��ֻ���¶��йأ��¶Ȳ��䣬��ѧƽ�ⳣ�����䣻��ֻ����ѹǿ����K���䡣
����ѧƽ�ⳣ��ֻ���¶��йأ��¶Ȳ��䣬��ѧƽ�ⳣ�����䣻��ֻ����ѹǿ����K���䡣
��3�������£�����0.5mol��L-1Na2SO3��Һ�����жϣ�(Na2SO3��һ��ˮ������ӷ���ʽ��SO32-+H2O![]() HSO3-+OH-)
HSO3-+OH-)
��Na2SO3ʱǿ�������Σ�SO32-����ˮ�ⷴӦ������Na2SO3��һ��ˮ������ӷ���ʽ������Һ�Լ��ԣ�pH>7��
����>��
������SO32-����ˮ�ⷴӦת��ΪHSO3-��H2SO3,��SO32-��Ŀ���٣�Ũ��Ҳ��С������Һ��c(Na+)>2c(SO32-)��
����>��
������ˮ�ⷴӦ�����ȷ�Ӧ�����ȸ���Һ��ˮ��ƽ�������ȣ�����Ӧ���ķ����ƶ���SO32-��Ũ�Ƚ���С
��Ϊ����С��
��4������a��bΪʯī�缫�����ݵ�Դ�缫�� b�缫Ϊ��������Һ�е�Cu2+�������õ����ӱ�Ϊͭ���ʣ����������ӣ��ü��ĵ缫��Ӧʽ��Cu2++2e-=Cu��
����Cu2++2e-=Cu��
�ڵ���ǵ��ԭ����һ����ҪӦ�á������ø�װ���������϶�ͭ��������Ӧ���Դ�ĸ������ӡ�
����������
��5����֪���ᱵ�ij����ܽ�ƽ��Ϊ��BaSO4(s)![]() Ba2+(aq)+SO42-(aq) Ksp=1.0��10-10�������ᱵ�ı�����Һ��Ksp=c��Ba2+����c��SO42-��=1.0��10-10�������ܽ�ƽ�ⷽ��ʽ��֪c��Ba2+��=c��SO42-������c2��Ba2+��=1.0��10-10��c��Ba2+��=1.0��10-5mol��L-1��
Ba2+(aq)+SO42-(aq) Ksp=1.0��10-10�������ᱵ�ı�����Һ��Ksp=c��Ba2+����c��SO42-��=1.0��10-10�������ܽ�ƽ�ⷽ��ʽ��֪c��Ba2+��=c��SO42-������c2��Ba2+��=1.0��10-10��c��Ba2+��=1.0��10-5mol��L-1��
����1.0��10-5mol��L-1

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�