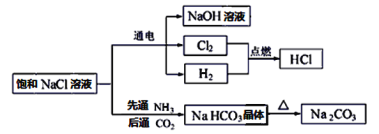
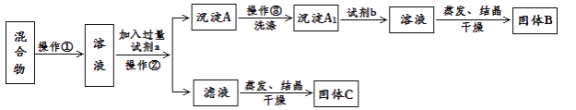
题目内容
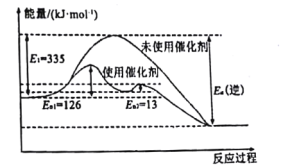
【题目】25℃、101kPa时,能量转化如图,下列说法正确的是
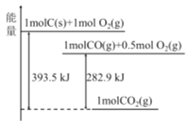
A.热化学方程式2CO(g)+O2(g)=2CO2(g)+282.9kJ
B.CO2是由极性键构成的极性分子
C.1molC(s)与1molCO2(g)生成2molCO(g)反应为放热反应
D.相同条件下,1molC(s)和0.5molO2(g)总能量高于1molCO(g)的能量
【答案】D
【解析】
根据图示能量图可以得到化学反应:① C(s)+O2(g)= CO2(g)△H=393.5kJmol1, ②CO(g)+ ![]() O2(g)= CO2(g)△H=282.9kJmol1,据此回答。
O2(g)= CO2(g)△H=282.9kJmol1,据此回答。
A.根据图象可知,1molCO和0.5mol氧气完全反应生成1mol二氧化碳放出282.9kJ热量,则2molCO完全燃烧放出565.8kJ热量,正确的热化学方程式为:2CO(g)+O2(g)=2CO2(g)△H=565.8kJmol1,故A错误;
B.二氧化碳是直线型结构,空间高度对称,CO2是由极性键构成的非极性分子,故B错误;
C.根据反应:① C (s)+O2(g)= CO2(g)△H=393.5kJmol1, ②CO(g)+![]() O2(g)= CO2(g)△H=282.9kJmol1,①-②×2,可以得到反应C(s)+ CO2(g)=2 CO(g),△H =-393.5kJ/mol-(-282.9×2)=172.3 kJ/mol>0,为吸热反应,故C错误;
O2(g)= CO2(g)△H=282.9kJmol1,①-②×2,可以得到反应C(s)+ CO2(g)=2 CO(g),△H =-393.5kJ/mol-(-282.9×2)=172.3 kJ/mol>0,为吸热反应,故C错误;
D.根据反应:① C (s)+O2(g)= CO2(g)△H=393.5kJmol1, ②CO(g)+ ![]() O2(g)= CO2(g)△H=282.9kJmol1,①-②得到C (s) +
O2(g)= CO2(g)△H=282.9kJmol1,①-②得到C (s) +![]() O2(g)=CO (g) △H=-110.6 kJmol1,为放热反应,反应物的总能量大于生成物的总能量,故D正确;
O2(g)=CO (g) △H=-110.6 kJmol1,为放热反应,反应物的总能量大于生成物的总能量,故D正确;
答案选D。