题目内容
【题目】氨气在工业上有广泛用途。请回答以下问题:
(1)工业上利用N2(g)+3H2(g) ![]() 2NH3(g) H<0合成氨,某小组为了探究外界条件对该反应的影响,以c0 mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图A。
2NH3(g) H<0合成氨,某小组为了探究外界条件对该反应的影响,以c0 mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图A。
①相对a而言,b可能改变的条件是 ,判断的理由是__________________。
②a条件下,0~t0的平均反应速率v(N2)= mol·L-1·min-1。 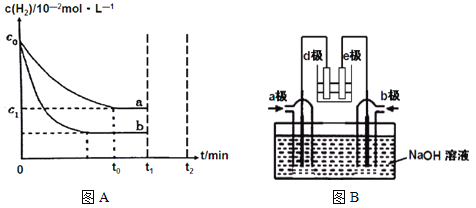
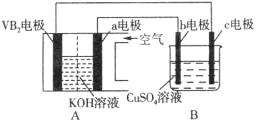
(2)有人利用NH3和NO2构成电池的方法,既能实现有效消除氮氧化物的排放减少环境污染,又能充分利用化学能进行粗铝的精炼,如图B所示,e极为精铝。
a极通入 气体(填化学式),判断的理由是___________________________________
(3)某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反应,图C为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。若体系在T2、60MPa下达到平衡。
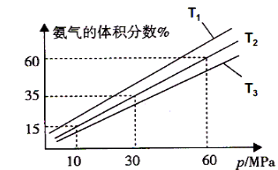
图C
①能判断N2(g)+3H2(g)![]() 2NH3(g)达到平衡的是______(填序号)。
2NH3(g)达到平衡的是______(填序号)。
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(N2)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②若T1、T2、T3温度下的平衡常数分别为K1、K2、K3,则K1、K2、K3由大到小的排序为 .
③此时N2的平衡分压为 MPa。(分压=总压×物质的量分数)
计算出此时的平衡常数Kp= 。(用平衡分压代替平衡浓度计算,结果保留2位有效数字并带上单位)
【答案】(1)①增大c(N2) ,a、b起始浓度相同,b到达平衡的时间缩短且氢气的转化率增大。②(c0-c1)/300t0
(2)NO2, e为精铝,发生还原反应,所以d极发生氧化反应,则a极为正极
(3)① bd ②K1>K2>K3 ③90.043(Mpa)-2。
【解析】
试题分析:(1)①根据图A知a、b两种条件下氢气起始浓度相同,b条件下到达平衡的时间缩短且氢气的转化率增大,相对a而言,b可能改变的条件是增大c(N2)。②a条件下,0~t0时氢气的浓度变化为(c0-c1)×10-2 mol/L,则氮气的浓度变化为(c0-c1)/300mol/L,平均反应速率v(N2)= (c0-c1)/300t0mol·L-1·min-1。
(2)根据题意知该电池的电池反应为8NH3+6NO2==7N2+12H2O,粗铝的精炼,e极为精铝,则e为电解池的阴极,d为电解池的阳极,a极为电池的正极,发生还原反应,通入的气体为NO2。
(3)① a.反应在等温等压条件下进行,容器内压强不随时间变化而变化,压强不变不能说明反应达到平衡,错误;b.该反应正向为气体物质的量减小的反应,反应在等温等压条件下进行,随着反应的进行容器内气体的物质的量逐渐减小,容器的体积逐渐减小,混合气体的密度逐渐减小,当密度不再发生变化说明反应达到平衡状态,正确;c.v正(N2)=3v逆(H2),v正(N2):v逆(H2)=3 ,不等于化学计量数之比,反应未达平衡状态,错误;d.该反应正向为气体物质的量减小的反应,随着反应的进行,混合气体的物质的量逐渐减小,平均相对分子质量逐渐增大,当混合气体的平均摩尔质量不再发生变化说明反应达到平衡状态,正确,选bd;②合成氨的反应正向为放热反应,升高温度平衡逆向移动,氨气的体积分数减小,结合图C知温度:T1<T2<T3,则K1、K2、K3由大到小的排序为K1>K2>K3;③利用三行式分析。设转化的氮气的物质的量为x。
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始物质的量(mol)9 23 0
转化物质的量(mol)x 3x 2x
平衡物质的量(mol)9-x 23-3x 2x
根据阿伏伽德罗定律:等温等压条件下,气体的体积之比等于气体的物质的量之比。根据图C知体系在T2、60MPa下达到平衡时氨气的体积分数为60%,则2x/(32-2x)=60%,解得x=6mol,平衡时N2的物质的量为3mol,气体总物质的量为20mol,此时N2的平衡分压为60MPa×3/20=9Mpa,同理计算H2的平衡分压为15Mpa,NH3的平衡分压为36Mpa,则平衡常数Kp=p2(NH3)/p(N2)p3(H2)=362÷(9×153)=0.043(Mpa)-2。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案【题目】【加试题】乙酰苯胺具有解热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称,其制备原理如下:
已知:![]()
①苯胺易被氧化。
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 |
乙酰苯胺 | 114.3 | 305 | 微溶于冷水,易溶于热水 |
苯胺 | -6 | 184.4 | 微溶于水 |
醋酸 | 16.6 | 118 | 易溶于水 |
实验步骤如下:
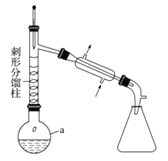
步骤1:在a中,加入9mL (0.10 mol)苯胺、15 mL(0.27 mol)冰醋酸及少许锌粉,依照上图装置组装仪器。
步骤2:控制温度计读数在105℃左右,小火加热回流至反应完全。
步骤3:趁热将反应混合物倒入盛有100 mL 冷水的烧杯中,冷却后抽滤、洗涤,得到粗产品。
步骤4:将步骤3所得粗产品进一步提纯后,称得产品质量为10.8g。
请回答下列问题:
(1)仪器a的名称为 ,所选仪器a的最佳规格是 (填序号)。
A. 25 mL B.50 mL C.100 mL D.250 mL
(2)实验中加入少许锌粉的目的是 。
(3)步骤2中,控制温度计读数在105℃左右的原因是 。
(4)判断反应已基本完全的方法为 。
(5)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是 。
(6)步骤4中粗产品进一步提纯,该提纯方法是 。
(7)本次实验的产率为 。
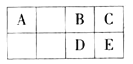
【题目】现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
A | 基态原子最外层电子数是次外层的三倍 |
B | 基态原子核外有13种不同运动状态的电子 |
C | 与B同一周期,原子中未成对电子数是同周期中最多 |
D | D2-的核外电子排布与氩原子相同 |
E | 是ds区原子序数最小的元素 |
(1)请把B以及B同周期且原子序数比B小的原子按第一电离能从大到小的顺序排列:____________(用相应的元素符号表示).A、D两种元素中,电负性A____________D (填“>”或“<”)
(2)A3分子的空间构型为____________,与其互为等电子体的分子为____________;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:____________,C7H15OH 中采用sp3杂化的原子共有____________个;
(4)E(NH3)42+配离子中存在的化学键类型有____________(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(NH3)42+具有对称的空间构型.且当 E(NH3)42+中的两个NH3分子被两个Cl一取代时。能得到两种不同结构的产物,则 E(NH3)42+的空间构型为____________(填序号)。
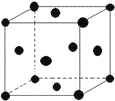
a.平面正方形b.正四面体 c.三角锥形 d.V形
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3(1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式____________(用M、r、ρ表示)。