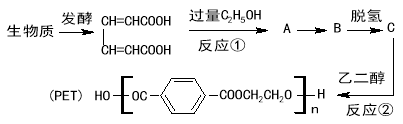
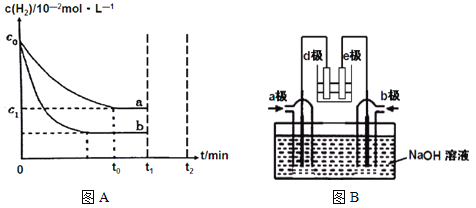
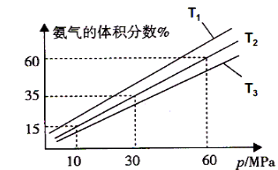
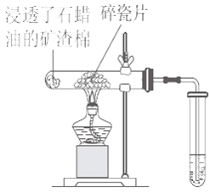
��Ŀ����
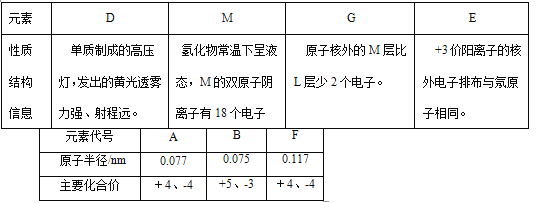
����Ŀ����������Ԫ�أ�����A��B��C��D��EΪԭ����������������ԭ��������������36����������������Ϣ���ش����⣮
A | ��̬ԭ�������������Ǵ��������� |
B | ��̬ԭ�Ӻ�����13�ֲ�ͬ�˶�״̬�ĵ��� |
C | ��Bͬһ���ڣ�ԭ����δ�ɶԵ�������ͬ��������� |
D | D2-�ĺ�������Ų����ԭ����ͬ |
E | ��ds��ԭ��������С��Ԫ�� |
��1�����B�Լ�Bͬ������ԭ��������BС��ԭ�Ӱ���һ�����ܴӴ�С��˳�����У�____________(����Ӧ��Ԫ�ط��ű�ʾ)��A��D����Ԫ���У��縺��A____________D (����������������)
��2��A3���ӵĿռ乹��Ϊ____________�����以Ϊ�ȵ�����ķ���Ϊ____________��
��3��������ˮ�е��ܽ��C7H15OH���Ҵ��͵�ԭ���ǣ�____________��C7H15OH �в���sp3�ӻ���ԭ�ӹ���____________����
��4��E(NH3)42+�������д��ڵĻ�ѧ��������____________(�����):
����λ�� �������� �����Թ��ۼ� ���Ǽ��Թ��ۼ� �����Ӽ� �����
�� E(NH3)42+���жԳƵĿռ乹�ͣ��ҵ� E(NH3)42+�е�����NH3���ӱ�����Clһȡ��ʱ���ܵõ����ֲ�ͬ�ṹ�IJ���� E(NH3)42+�Ŀռ乹��Ϊ____________(�����)��
a��ƽ��������b���������� c�������� d��V��
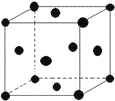
��5������E������ͼ��ʾ����֪EԪ�����ԭ������ΪM��ԭ�Ӱ뾶Ϊr pm���ܶ�Ϊ��g/cm3(1pm=10-10cm)��ôд������٤������NA�ı���ʽ____________(��M��r������ʾ)��
���𰸡���1��Mg��Al��Na������
��2��V��SO2��
��3���Ҵ��е��ǻ���ˮ���ǻ��ṹ���������ܽ�ȴ�C7H15OH����������ˮ���ǻ��ṹ���Ƴ̶�С�����ܽ��С��8��
��4���٢���a��
��5��![]()
�����������������A��̬ԭ�������������Ǵ���������������������������8��ԭ��ֻ����2�����Ӳ㣬����������Ϊ6����AΪOԪ�أ�B��̬ԭ�Ӻ�����13�ֲ�ͬ�˶�״̬�ĵ��ӣ���BΪAlԪ�أ�C��Bͬһ���ڣ�ԭ����δ�ɶԵ�������ͬ���������ģ���CΪPԪ�أ� D2-�ĺ�������Ų����ԭ����ͬ����DΪSԪ�أ�E��ds��ԭ��������С��Ԫ�أ���EΪCuԪ�ء�
��1��BΪAl��ͬ����ԭ��������AlС����Na��Mg��ͬ����Ԫ�ص�һ�����ܴ����ҳ��������ƣ���Mgԭ��3s���Ϊȫ���ȶ�״̬�����һ�����ܴ���Al�ģ����Ե�һ������Mg��Al��Na��ͬ�������϶��µ縺�Լ�С�����Ե縺��O��S���ʴ�Ϊ��Mg��Al��Na������
��2��O3��������ԭ�ӹµ��Ӷ���=![]() ��(62��2)=1���۲���Ӷ���=2+1=3�����ӹ���ΪV�Σ�O3����ԭ����Ϊ3���۵�����Ϊ18������ȵ�����ΪSO2���ʴ�Ϊ��V�Σ�SO2��
��(62��2)=1���۲���Ӷ���=2+1=3�����ӹ���ΪV�Σ�O3����ԭ����Ϊ3���۵�����Ϊ18������ȵ�����ΪSO2���ʴ�Ϊ��V�Σ�SO2��
��3���Ҵ��е��ǻ���ˮ���ǻ��ṹ���������ܽ�ȴ�C7H15OH����������ˮ���ǻ��ṹ���Ƴ̶�С�����ܽ��С��C7H15OH������Cԭ�ӡ�Oԭ�ӵļ۲���ӶԾ�Ϊ4�����Բ���sp3�ӻ���ԭ����8��ԭ�ӣ��ʴ�Ϊ���Ҵ��е��ǻ���ˮ���ǻ��ṹ���������ܽ�ȴ�C7H15OH����������ˮ���ǻ��ṹ���Ƴ̶�С�����ܽ��С��8��
��4��[Cu(NH3)4]2+��Cu2+��NH3֮��Ļ�ѧ��Ϊ��λ����N-HΪ���Թ��ۼ����� Cu(NH3)42+���жԳƵĿռ乹�ͣ��ҵ� Cu(NH3)42+�е�����NH3���ӱ�����Clȡ��ʱ���ܵõ����ֲ�ͬ�ṹ�IJ���� Cu(NH3)42+�ռ乹��Ϊƽ�������Σ��ʴ�Ϊ���٢���a��
��5������Cu������ԭ����Ϊ8��![]() +6��
+6��![]() =4����������Ϊ4��
=4����������Ϊ4��![]() g��ԭ�Ӱ뾶Ϊr pm�����ⳤd=
g��ԭ�Ӱ뾶Ϊr pm�����ⳤd=![]() ��4r=2
��4r=2![]() r��10-10cm����4��
r��10-10cm����4��![]() g=(2
g=(2![]() r��10-10cm)3����g/cm3����NA=
r��10-10cm)3����g/cm3����NA=![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��

 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д�