题目内容
6.短周期元素A、B、C、D的原子序数依次增大,它们原子的最外层电子数之和为16,A与D同主族,B+与A2-具有相同的电子层结构,C原子的最外层电子数等于A原子最外层电子数的一半,则下列叙述正确的是( )| A. | B2A2和B2A中阴阳离子的个数比相同 | |
| B. | 原子半径的大小顺序:r(D)>r(C)>r(B)>r(A) | |
| C. | D的简单气态氢化物的热稳定性比A的强 | |
| D. | 元素C的单质是一种高硬度、高熔点的金属 |
分析 短周期元素A、B、C、D的原子序数依次增大,B+与A2-具有相同的电子层结构,则A为O元素,B为Na元素;A与D同主族,则D为S元素;C原子的最外层电子数等于A原子最外层电子数的一半,则C原子最外层电子数为3,故C为Al元素,据此解答.
解答 解:短周期元素A、B、C、D的原子序数依次增大,B+与A2-具有相同的电子层结构,则A为O元素,B为Na元素;A与D同主族,则D为S元素;C原子的最外层电子数等于A原子最外层电子数的一半,则C原子最外层电子数为3,故C为Al元素.
A.Na2O2和Na2O中阴阳离子的个数比均为1:2,故A正确;
B.同一周期从左到右半径原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Al>S>O,故B错误;
C.非金属性A(O)>D(S),故氢化物稳定性A>D,故C错误;
D.Al元素单质,硬度小、熔点不是很高,故D错误,
故选:A.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,离子电子层结构相同为推断突破口,注意抓住短周期元素,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.A、B、C、D四种元素在周期表中分别处于元素X的四周(如图)已知元素X最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它们所处的同族元素中最小的.
(1)写出各元素的符号:ASiBNCSDAs.
(2)写出C、D、X气态氢化物最高价氧化物对应水化物的化学式,其酸性由强到弱的顺序为H2SO4>H3PO4>H3AsO4.
(3)写出A、B、X气态氢化物的化学式,其稳定性由强到弱的顺序为NH3>PH3>SiH4.
| B | ||
| A | X | C |
| D |
(2)写出C、D、X气态氢化物最高价氧化物对应水化物的化学式,其酸性由强到弱的顺序为H2SO4>H3PO4>H3AsO4.
(3)写出A、B、X气态氢化物的化学式,其稳定性由强到弱的顺序为NH3>PH3>SiH4.
1.化学中很多规律(性质)都有其适用范围,下列根据其推出的结论正确的是( )
| 选项 | 规律(或性质) | 结 论 |
| A | 主族元素最高正化合价等于族序数 | 第VⅡA族元素最高正价都是+7 |
| B | SO2和湿润的Cl2都有漂白性 | 二者混合后漂白性更强 |
| C | 常湿下铜与浓硝酸反应可以制取NO2 | 常温下铁与浓硝酸反应也可以制取NO2 |
| D | 较强酸可以制取较弱酸 | CO2通入NaClO溶液液中能生成HC10 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
11.分类是化学学习和研学的常用手段.下列分类依据和结论正确的是( )
| A. | 纯碱、Na2O2、NH4NO3、Ca(OH)2均为离子化合物 | |
| B. | HCl、H2SO4、HNO3均具有氧化性,都是氧化性酸 | |
| C. | 经分析某物质只含有一种元素,则该物质一定是纯净物 | |
| D. | 金属氧化物一定是碱性氧化物 |
18.阿司匹林是用苯酚等原料合成的,而苯酚是用一氯取代物氯苯为原料制造的.其反应的方程式如下: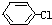 +NaOH→
+NaOH→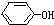 +NaCl,该反应的反应类型属于( )
+NaCl,该反应的反应类型属于( )
 +NaOH→
+NaOH→ +NaCl,该反应的反应类型属于( )
+NaCl,该反应的反应类型属于( )| A. | 加成反应 | B. | 取代反应 | C. | 氧化还原反应 | D. | 置换反应 |
1.化学与人类生产、生活密切相关,下列有关说法正确的是( )
| A. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| B. | PM 2.5亦称可入肺颗粒物,分散在空气中形成胶体,能吸附有毒有害物$\frac{2b}{a-2b}$质 | |
| C. | “海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 | |
| D. | 绚丽缤纷的烟花中添加了含钾、钠、钙、钡等金属元素的化合物 |
 如图为向100mL 2mol/L AlCl3溶液中加入2mol/L NaOH溶液过程中,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线.试回答:
如图为向100mL 2mol/L AlCl3溶液中加入2mol/L NaOH溶液过程中,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线.试回答: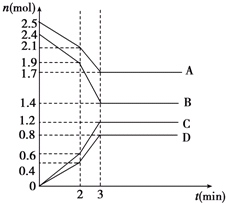 在某一容积为2L的恒容密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示.回答下列问题:
在某一容积为2L的恒容密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示.回答下列问题: