题目内容
1.物质的类别和核心元素的化合价是研究物质性质的两个重要视角.硫及其化合物与价态变化为坐标的二维转化关系如图2所示.完成下列填空: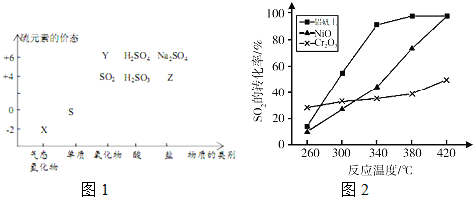
(1)图中X的水溶液在空气中放置易变浑浊,写出反应的化学方程式:2H2S+O2=2S↓+2H2O;
(2)下列物质用于Na2S2O3制备,从氧化还原反应的角度分析,理论上有可能实现的方案是bd(选填编号).
a.Na2S+S b.Z+S c.Na2SO3+Y d.NaHS+NaHSO3
(3)请补充完整焙烧明矾的化学方程式:4KAl(SO4)2•12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O
(4)研究反应Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O的速率时,下列方案合理的是b(选填编号).
a.测定一段时间内生成SO2的体积,得出该反应的速率
b.研究浓度、温度等因素对该反应速率的影响,比较反应出现浑浊的时间
c.用Na2S2O3(s)分别与浓、稀硫酸反应,研究浓度对该反应速率的影响
(5)治理含CO、SO2的烟道气,以铝钒土做催化剂,将CO、SO2在380℃时转化为S和一种无毒气体.已知:①硫的熔点:112.8℃、沸点:444.6℃;②反应每得到1mol硫,放出270kJ的热量.写出该治理烟道气反应的热化学方程式2CO(g)+SO2(g)$\frac{\underline{\;铝钒土\;}}{380℃}$S(l)+2CO2(g)△H=-270kJ/mol.
(6)其他条件相同、催化剂不同时,上述反应中 SO2 的转化率随反应温度的变化如图2.不考虑催化剂价格因素,生产中选铝矾土做催化剂的主要原因是铝钒土作催化剂,在相对较低温度下,单位时间内获得较高的SO2转化率,能耗小.
分析 (1)X为H2S,H2S在空气中变浑浊是因为被氧气氧化为S;
(2)Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2;
(3)由原子和元素守恒可知,缺项为水,结合电子、原子守恒配平;
(4)硫代硫酸钠与稀硫酸反应生成了单质硫,溶液变浑浊,反应速率越快,出现浑浊时间越短;
(5)反应每得到1mol硫,放出270kJ的热量,以此书写热化学方程式;
(6)由图可知,相同条件下铝钒土作催化剂时,二氧化硫的转化率最大.
解答 解:(1)X为H2S,H2S在空气中变浑浊是因为被氧气氧化为S,反应的化学方程式为2H2S+O2=2S↓+2H2O,故答案为:2H2S+O2=2S↓+2H2O;
(2)Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2,a中S化合价都小于2,c中S的化合价都大于2,bd符合题意,
故答案为:bd;
(3)由原子和元素守恒可知,缺项为水,反应中S元素的化合价由+6价降低为+4价,S元素的化合价由0升高为+4价,结合电子、原子守恒可知反应为4KAl(SO4)2•12H2O+3S$\frac{\underline{\;高温\;}}{\;}$2K2SO4+2Al2O3+9SO2↑+48H2O,故答案为:4;3;2;2;9;48H2O;
(4)根据硫代硫酸钠与稀硫酸反应生成了单质硫,溶液变浑浊,可以判断反应速率快慢,反应速率越快,出现浑浊时间越短,
故答案为:b;
(5)反应每得到1mol硫,放出270kJ的热量,热化学方程式为2CO(g)+SO2(g)$\frac{\underline{\;铝钒土\;}}{380℃}$S(l)+2CO2 (g)△H=-270kJ/mol,
故答案为:2CO(g)+SO2(g)$\frac{\underline{\;铝钒土\;}}{380℃}$S(l)+2CO2 (g)△H=-270kJ/mol;
(6)由图可知,生产中选铝钒土做催化剂的主要原因是铝钒土作催化剂,在相对较低温度下,单位时间内获得较高的SO2转化率,能耗小,
故答案为:铝钒土作催化剂,在相对较低温度下,单位时间内获得较高的SO2转化率,能耗小.
点评 本题考查较综合,涉及非金属性比较、氧化还原反应、反应速率及热化学方程式等,侧重反应原理中高频考点的考查,综合性较强,题目难度不大.

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案| A. | 吸收183kJ | B. | 吸收284kJ | C. | 放出183kJ | D. | 放出 248kJ |
| A. | “煤的液化”是指将煤加热变为液态 | |
| B. | “乙醇汽油”是为了增大燃烧的热值,在汽油中加入乙醇 | |
| C. | 光伏发电要用到铟,该元素是一种副族的金属元素 | |
| D. | 将燃料的燃烧反应设计为原电池,可以提高能量的利用率 |
| A. | 氯气和水的反应:C12+H2O=2H++Cl-+ClO- | |
| B. | 等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 硫酸与氢氧化钡溶液反应:Ba2++OH-+SO42-+H+=BaSO4↓+H2O |
 硫酸钡为强酸强碱的难溶性盐,俗名叫重晶石.
硫酸钡为强酸强碱的难溶性盐,俗名叫重晶石.(1)以浓硫酸为电解质,按如图装置实验,小灯泡昏暗.请写出浓硫酸的电离方程式H2SO4?H++HSO4-或2H2SO4?H3SO4++HSO4-;向硫酸中撒入硫酸钡细粉,灯泡会渐渐明亮起来.用化学方程式表示增亮的原因BaSO4+H2SO4=Ba2++2HSO4-.
(2)重晶石直接开发利率很难,目前主要是通过两种途径进行开发:
一是把重晶石碾碎撒入饱和碳酸钠溶液中,不停搅拌,尔后过滤,将滤渣投入相应的酸中溶解,转化为相应的水溶性钡盐.用离子方程式表示碳酸钠溶液溶蚀硫酸钡的原理CO32-+BaSO4?BaCO3+SO42-;
其二是高温热还原:BaSO4+4C═BaS+4CO …①
BaSO4+4H2═BaS+4H2O …②.试比较①②两种还原开发的优劣①原料易得,成本低,不足之处是原料原料率不高,污染严重;
②原料利用率高,不足之处是成本高,有副反应发生,产品纯度低;.CO能不能还原硫酸钡?若认为不能,请说明理由,若能,你认为应该如何促使反应顺利进行,写出反应方程式.BaS热水中易水解,生成的H2S受热分解,BaSO4+4CO=BaS+4CO2
②中氢可利用炼油中的重油CxHy催化氧化还原获得.其反应思路式为:2CxHy+4xH2O?2xCO2+y+4xH2,配平该反应方程式;指出氧化剂水、CxHy;还原剂CxHy.
(3)已知:
| 反应温度 | 300℃ | 400℃ | 500℃ | 600℃ | 700℃ |
| 平衡常数 | 3.8 | 5.7 | 8.5 | 9.2 | 9.8 |
②较理想的反应温度应该控制在500℃.
(4)请运用你所学知识,设计一个新的开发重晶石方案BaSO4+4H2=BaS+4H2O[利用生物催化剂,利用厌氧硫化菌].
(5)从理论上讲CxHy+H2O→CO2+H2的反应是一个焓增、熵增反应(从反应原理角度回答);该反应的逆向反应:CO2+H2→CxHy+H2O开发意义重大,你认为最需要解决的两大问题分别是①利用绿色能源、②寻找理想催化剂(生物催化剂).
| A. | 8:1 | B. | 2:1 | C. | 1:1 | D. | 1:2 |
| A. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类相同 | |
| B. | 由苯制取溴苯、硝基苯、环己烷的反应类型均属于取代反应 | |
| C. | 乙烷、苯、葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 | |
| D. | 乙酸乙酯、乙酸、乙醇均能和水互溶 |
| A. | 纯碱、Na2O2、NH4NO3、Ca(OH)2均为离子化合物 | |
| B. | HCl、H2SO4、HNO3均具有氧化性,都是氧化性酸 | |
| C. | 经分析某物质只含有一种元素,则该物质一定是纯净物 | |
| D. | 金属氧化物一定是碱性氧化物 |
 如图为向100mL 2mol/L AlCl3溶液中加入2mol/L NaOH溶液过程中,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线.试回答:
如图为向100mL 2mol/L AlCl3溶液中加入2mol/L NaOH溶液过程中,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线.试回答: