题目内容
6. 某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、S、NOX等进行研究具有重要意义.为减少SO2的排放,常采取的措施是:将煤转化为清洁气体燃料.涉及的化学反应为:
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、S、NOX等进行研究具有重要意义.为减少SO2的排放,常采取的措施是:将煤转化为清洁气体燃料.涉及的化学反应为:①H2(g)+$\frac{1}{2}{O_2}$(g)═H2O(g)△H=-241.8kJ•mol-1
②C(s)+$\frac{1}{2}{O_2}$(g)═CO(g)△H=-110.5kJ•mol-1
(1)反应①是放热反应还是吸热反应?放热反应,2molH2和1molO2的总能量大于2molH2O(g)总能量(填大于、小于或等于);
(2)依据反应②确定24g碳不完全燃烧生成CO(g)时放出的热量是221kJ;
(3)反应①表示是H2的燃烧热吗?不是,若1molH2O(l)完全转化为H2O(g)需要吸收44kJ的热量,则H2的燃烧热是△H=-285.8kJ/mol;
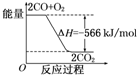
(4)已知CO转化成CO2的能量关系如图所示:写出该反应的热化学方程式:2CO(s)+O2(g)═2CO2(s)△H=-566kJ•mol-1;依据反应②和图形能量关系,则碳的燃烧热△H=-393.5kJ•mol-1;
(5)依据反应①、②写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ•mol-1;
(6)已知反应:C(s)+$\frac{1}{2}{O_2}$(g)═CO(g)△H1;C(s)+O2(g)═CO2(g)△H2;试比较△H1和△H2的大小:△H1>△H2(填“>”、“<”、“=”).
分析 (1)反应①为氢气燃烧反应,所以是放热反应,则2molH2和1molO2的总能量大于2molH2O(g)总能量;
(2)依据反应②C(s)+$\frac{1}{2}{O_2}$(g)═CO(g)△H=-110.5kJ•mol-1,得出1mol碳不完全燃烧生成CO(g)时放出的热量为110.5kJ,据此计算;
(3)燃烧热是指生成稳定的化合物,所以应生成液态水,根据1molH2O(l)完全转化为H2O(g)需要吸收44kJ的热量计算H2的燃烧热;
(4)根据图象书写热化学方程式;依据反应②和图形能量关系,根据盖斯定律计算碳的燃烧热;
(5)依据①H2(g)+$\frac{1}{2}{O_2}$(g)═H2O(g)△H=-241.8kJ•mol-1
②C(s)+$\frac{1}{2}{O_2}$(g)═CO(g)△H=-110.5kJ•mol-1
根据盖斯定律②-①进行计算;
(6)根据碳完全燃烧放出的热量比不完全放出的热量多以及放热焓变为负值比较.
解答 解:(1)反应①为氢气燃烧反应,所以是放热反应,则2molH2和1molO2的总能量大于2molH2O(g)总能量,故答案为:放热;大于;
(2)依据反应②C(s)+$\frac{1}{2}{O_2}$(g)═CO(g)△H=-110.5kJ•mol-1,得出1mol碳不完全燃烧生成CO(g)时放出的热量为110.5kJ,所以24g碳即2mol不完全燃烧生成CO(g)时放出的热量是110.5×2=221kJ,故答案为:221;
(3)燃烧热是指生成稳定的化合物,所以氢气燃烧应生成液态水,则反应①表示不是H2的燃烧热,又1molH2O(l)完全转化为H2O(g)需要吸收44kJ的热量,所以H2的燃烧热为△H=-241.8-44=-285.8kJ•mol-1,故答案为:△H=-285.8kJ•mol-1;
(4)由图象可知2molCOHE 1mol氧气生成2mol二氧化碳放出566KJ的热量,所以热化学方程式为2CO(s)+O2(g)═2CO2(s)△H=-566kJ•mol-1,a;再由②C(s)+$\frac{1}{2}{O_2}$(g)═CO(g)△H=-110.5kJ•mol-1,b,根据盖斯定律$\frac{1}{2}$a+b,则碳的燃烧热为△H=-$\frac{1}{2}$×566-110.5=-393.5kJ•mol-1,
故答案为:2CO(s)+O2(g)═2CO2(s)△H=-566kJ•mol-1;△H=-393.5kJ•mol-1;
(5)依据①H2(g)+$\frac{1}{2}{O_2}$(g)═H2O(g)△H=-241.8kJ•mol-1
②C(s)+$\frac{1}{2}{O_2}$(g)═CO(g)△H=-110.5kJ•mol-1
根据盖斯定律②-①,则焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ•mol-1;故答案为:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ•mol-1;
(6)因为碳完全燃烧放出的热量比不完全放出的热量多,又放热焓变为负值,所以C(s)+$\frac{1}{2}{O_2}$(g)═CO(g)△H1;C(s)+O2(g)═CO2(g)△H2;试比较△H1和△H2的大小:△H1>△H2,故答案为:>.
点评 本题考查了化学反应的能量变化,燃烧热的定义和盖斯定律的应用,题目较简单.

| A. | Fe2+、Mg2+、NO3-、SO42- | B. | K+、Na+、OH-、Cl- | ||
| C. | Na+、Ba2+、OH-、Cl- | D. | Ba2+、HCO3-、NO3-、H+ |
| O | |
| S | |
| Se | Br |
| A. | 原子序数为34 | B. | H2Se比HBr稳定 | ||
| C. | 最高价氧化物的化学式是SeO2 | D. | 位于元素周期表第四周期第ⅣA族 |
| 阳离子 | H+、NH4+、Mg2+、Ba2+、Al3+ |
| 阴离子 | OH-、Cl-、HCO3-、NO3-、SO42- |
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
| A. | NH4Cl | B. | Mg(OH)2 | C. | Al2O3 | D. | Fe2O3 |
| A. | 液氯 | B. | 食盐水 | C. | 漂白粉 | D. | 氢氧化铁胶体 |
| A. | 将金属钠保存在煤油中 | |
| B. | 液溴盛放在棕色细口的玻璃瓶中,加一些水,并密封置于低温处 | |
| C. | 碘化银盛放在无色玻璃瓶中,塞紧玻璃塞 | |
| D. | 新制的氯水盛放在棕色细口瓶中,塞紧玻璃塞 |
| A. | 把pH=6的盐酸稀释1000倍 | |
| B. | 把pH=8的NaOH溶液稀释10倍 | |
| C. | 把10mL 1×10-5mol/L的H2SO4溶液与10mL 4×10-5mol/L的NaOH溶液相混合 | |
| D. | 把c(OH-)=10-5mol/L的NaOH溶液10mL加到100mL浓度为10-4mol/L的NaOH溶液中 |