题目内容
17.硒(Se)是人体必需的微量元素,在元素周期表中的位置如图.下列关于硒元素的叙述正确的是( )| O | |
| S | |
| Se | Br |
| A. | 原子序数为34 | B. | H2Se比HBr稳定 | ||
| C. | 最高价氧化物的化学式是SeO2 | D. | 位于元素周期表第四周期第ⅣA族 |
分析 A.S原子序数是16,S和Se原子序数相差18;
B.元素非金属性元素越强,其氢化物的稳定性越强;
C.主族元素最高化合价与其族序数相等,但O、F元素除外;
D.Se和S属于第VIA族,且Se位于第四周期.
解答 解:A.S原子序数是16,S和Se原子序数相差18,则Se原子序数=16+18=34,故A正确;
B.元素非金属性元素越强,其氢化物的稳定性越强,非金属性Se<Br,所以稳定性H2Se<HBr,故B错误;
C.主族元素最高化合价与其族序数相等,但O、F元素除外,Se位于第VIA族,则最高价氧化物的化学式是SeO3,故C错误;
D.主族元素最外层电子数与其族序数相等,Se、S、O原子最外层电子数是6,Se和S属于第VIA族,且Se位于第四周期,故D错误;
故选A.
点评 本题考查非金属元素在周期表中的位置及其性质递变规律,为高频考点,明确元素周期表结构、元素在周期表中的位置是解本题关键,注意规律中的异常现象,题目难度不大.

练习册系列答案
相关题目
8.设NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| B. | 60 g乙酸分子中含σ键总数为6NA | |
| C. | 1.0L的0.1 mol•L-1Na2S溶液中含有的S2-离子数为0.1NA | |
| D. | 常温下,35.5g Cl2与足量的NaOH溶液充分反应,转移的电子数为0.5NA |
12.以下4种有机物的分子式都是C4H10O:①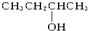 ②
②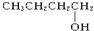 ③
③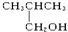 ④
④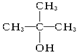 其中能被氧化为含相同碳原子数的醛的是( )
其中能被氧化为含相同碳原子数的醛的是( )
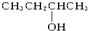 ②
②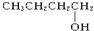 ③
③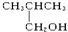 ④
④ 其中能被氧化为含相同碳原子数的醛的是( )
其中能被氧化为含相同碳原子数的醛的是( )| A. | ①② | B. | 只有② | C. | ③④ | D. | ②③ |
2.下列化学反应的离子方程式正确的是( )
| A. | 氢氧化亚铁溶于稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| B. | 醋酸与NaHCO3溶液反应:H++HCO3-═CO2↑+H2O | |
| C. | 向KI溶液中加入FeCl3溶液:Fe3++2I-═Fe2++I2 | |
| D. | 将铝片加入烧碱溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
9.现有H2O、NH3、CH4三种物质,它们分别都含有等物质的量的氢原子,则三种物质的物质的量之比为( )
| A. | 1:1:1 | B. | 6:3:2 | C. | 4:3:2 | D. | 6:4:3 |
7.下列说法正确的是( )
| A. | API含义是空气污染指数,它是衡量空气质量好坏的指标,数值越大,空气质量就越好 | |
| B. | 空气质量级别分为5级,5级为优,1级为重度污染 | |
| C. | 正常雨水的PH=7 | |
| D. | SO2是形成酸雨的主要物质之一,主要来源于化石燃料的燃烧 |

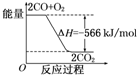 某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、S、NOX等进行研究具有重要意义.为减少SO2的排放,常采取的措施是:将煤转化为清洁气体燃料.涉及的化学反应为:
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、S、NOX等进行研究具有重要意义.为减少SO2的排放,常采取的措施是:将煤转化为清洁气体燃料.涉及的化学反应为: