题目内容
16.下列无色溶液中离子可大量共存的是( )| A. | Fe2+、Mg2+、NO3-、SO42- | B. | K+、Na+、OH-、Cl- | ||
| C. | Na+、Ba2+、OH-、Cl- | D. | Ba2+、HCO3-、NO3-、H+ |
分析 溶液无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.亚铁离子为有色离子,不满足溶液无色的条件;
B.四种离子之间不反应,都是无色离子;
C.四种离子之间不满足离子反应发生条件,且都是无色离子;
D.碳酸氢根离子与氢离子反应生成二氧化碳气体和水.
解答 解:无色溶液可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.Fe2+为有色离子,不满足溶液无色的要求,故A错误;
B.K+、Na+、OH-、Cl-之间不反应,且都为无色离子,在溶液中能够大量共存,故B正确;
C.Na+、Ba2+、OH-、Cl-之间不发生反应,都是无色离子,在溶液中能够大量共存,故C正确;
D.HCO3-、H+之间反应生成二氧化碳气体和水,在溶液中不能大量共存,故D错误;
故选BC.
点评 本题考查离子共存的判断,为中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
6.下列反应的离子方程式正确的是( )
| A. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- | |
| B. | 硝酸银溶液中滴加过量氨水:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O | |
| C. | 用惰性电极电解氯化镁溶液:2Cl-+2H2O═H2↑+Cl2↑+2OH- | |
| D. | 稀硝酸中加入过量铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O |
4. 已知:25℃时某些弱酸的电离平衡常数(如表),如图图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法正确的是
已知:25℃时某些弱酸的电离平衡常数(如表),如图图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法正确的是
( )
 已知:25℃时某些弱酸的电离平衡常数(如表),如图图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法正确的是
已知:25℃时某些弱酸的电离平衡常数(如表),如图图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法正确的是| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=4.7×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c(HR)×c(O{H}^{-})}{c({R}^{-})}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
11.下列实验操作中有错误的是( )
| A. | 蒸馏操作时,应使温度计水银球置于混合液中 | |
| B. | 蒸馏操作时,冷却水应从冷凝管的下口通入,上口流出 | |
| C. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸发操作时,应使混合物中的水分完全蒸干后,再停止加热 |
1.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,2.8 g N2与C2H4的混合气体中含有的电子数为1.4NA | |
| B. | 标准状况下,1.12L NO与1.12L O2的混合物中含有的原子数为0.2NA | |
| C. | 25℃时pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| D. | 常温下,1L 0.1mol/L 的NH4NO3溶液中氧原子数为0.3NA |
8.设NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| B. | 60 g乙酸分子中含σ键总数为6NA | |
| C. | 1.0L的0.1 mol•L-1Na2S溶液中含有的S2-离子数为0.1NA | |
| D. | 常温下,35.5g Cl2与足量的NaOH溶液充分反应,转移的电子数为0.5NA |

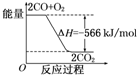 某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、S、NOX等进行研究具有重要意义.为减少SO2的排放,常采取的措施是:将煤转化为清洁气体燃料.涉及的化学反应为:
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、S、NOX等进行研究具有重要意义.为减少SO2的排放,常采取的措施是:将煤转化为清洁气体燃料.涉及的化学反应为: