题目内容
16.常温下,下列溶液中与1×10-5mol/L的NaOH溶液pH相同的是( )| A. | 把pH=6的盐酸稀释1000倍 | |
| B. | 把pH=8的NaOH溶液稀释10倍 | |
| C. | 把10mL 1×10-5mol/L的H2SO4溶液与10mL 4×10-5mol/L的NaOH溶液相混合 | |
| D. | 把c(OH-)=10-5mol/L的NaOH溶液10mL加到100mL浓度为10-4mol/L的NaOH溶液中 |
分析 常温下,1.0×10-5mol/L的NaOH溶液的pH为9.
A、把pH=6的盐酸稀释1000倍,PH接近7;
B、把pH=8的NaOH溶液稀释10倍,PH接近7;
C、先根据混合溶液的氢氧根离子浓度,再结合离子积常数计算氢离子浓度,根据溶液pH的公式计算;
D、c(OH-)=10-5mol/L的NaOH溶液10mL加到100mLNaOH浓度为10-4mol/L,氢氧根离子浓度一定小于1×10-4mol/L.
解答 解:常温下,1.0×10-5mol/L的NaOH溶液的pH为9.
A、把pH=6的盐酸稀释1000倍,PH接近7,故A错误;
B、把pH=8的NaOH溶液稀释10倍,PH接近7,故B错误;
C、混合溶液中氢氧根离子浓度为$\frac{4×1{0}^{-5}mol/L×0.01L-1×1{0}^{-5}mol/L×2×0.01L}{0.02L}$=1.0×10-5mol/L,pH=9,故C正确;
D、c(OH-)=10-5mol/L的NaOH溶液10mL加到100mLNaOH浓度为10-4mol/L,氢氧根离子浓度一定小于1×10-4mol/L大于1×10-5mol/L,故溶液的pH一定介于10到9之间,故D错误;
故选C.
点评 本题考查了pH的简单计算,先计算溶液中氢离子浓度,再根据pH公式计算溶液的pH值.

练习册系列答案
相关题目
7.下列说法正确的是( )
| A. | API含义是空气污染指数,它是衡量空气质量好坏的指标,数值越大,空气质量就越好 | |
| B. | 空气质量级别分为5级,5级为优,1级为重度污染 | |
| C. | 正常雨水的PH=7 | |
| D. | SO2是形成酸雨的主要物质之一,主要来源于化石燃料的燃烧 |
4.已知酯在金属钠存在下与乙醇混合加热蒸馏,可使酯还原成醇,反应为RCOOR'+4[H]$\stackrel{Na+CH_{3}CH_{2}OH}{→}$RCH2OH+R'OH,现有酯C5H11COOC6H13,用上述方法还原,所得到的产物是( )
| A. | C6H13OH和C5H11OH | B. | C6H13OH | ||
| C. | C5H11OH | D. | C11H23OH |
1.在下列转化中必须加入还原剂才能实现的是( )
| A. | CuSO4→Cu | B. | CaCO3→CO2 | C. | HCl→Cl2 | D. | C→CO2 |
8.若NA表示阿伏加德罗常数的数值,下列说法错误的是( )
| A. | 1 mol H2O所含质子数为10NA | |
| B. | 在标准状况下,0.5NA个氯气分子所占的体积约是11.2L | |
| C. | 标准状况下,22.4 L汽油所含的分子数为NA | |
| D. | 1克氢气所含原子数约为6.02×1023 |
5.下列各物质不能通过化合反应直接得到的是( )
| A. | CH3COOH | B. | C3H8 | C. | Fe(OH)3 | D. | CuS |
6.下列有关0.2mol•L-1 BaCl2溶液的说法中,不正确的是( )
| A. | 500 mL溶液中Ba2+和Cl-总数为0.3NA | |
| B. | 500 mL溶液中Ba2+浓度为0.2 mol•L-1 | |
| C. | 500 mL溶液中Cl-总数为0.2 NA | |
| D. | 500 mL溶液中Cl-浓度为0.2 mol•L-1 |
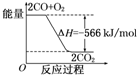 某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、S、NOX等进行研究具有重要意义.为减少SO2的排放,常采取的措施是:将煤转化为清洁气体燃料.涉及的化学反应为:
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、S、NOX等进行研究具有重要意义.为减少SO2的排放,常采取的措施是:将煤转化为清洁气体燃料.涉及的化学反应为: