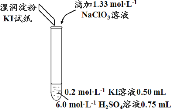
题目内容
【题目】某实验小组同学模拟工业制碘的方法,探究ClO![]() 和I
和I![]() 的反应规律。实验操作及现象如下:
的反应规律。实验操作及现象如下:
实验及试剂 | 编号 | 无色NaClO3 溶液用量 | 试管中 溶液颜色 | 淀粉KI 试纸颜色 |
| 1 | 0.05 mL | 浅黄色 | 无色 |
2 | 0.20 mL | 深黄色 | 无色 | |
3 | 0.25 mL | 浅黄色 | 蓝色 | |
4 | 0.30 mL | 无色 | 蓝色 |
(1)取实验2后的溶液,进行如下实验:
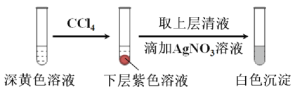
经检验,上述白色沉淀是AgCl。写出加入0.20 mL NaClO3后,溶液中ClO3-和I-发生反应的离子方程式: 。
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-。
作出假设: NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)中的反应产物继续反应,同时生成Cl2。
进行实验:
①取少量实验4中的无色溶液进行以下实验,进一步佐证其中含有IO3-。
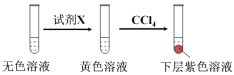
其中试剂X可以是 (填字母序号)。
a.碘水 b.MnO4溶液 c.NaHSO3溶液
② 有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2,便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30 mL 1.33 mol·L1 NaClO3溶液后,发现湿润的淀粉试纸没有明显变化。进行以上对比实验的目的是 ,进一步佐证实验4中生成了Cl2。
获得结论:NaClO3溶液用量增加导致溶液褪色的原因是 (用离子方程式表示)。
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如下实验结果:
编号 | 6.0 mol·L1 H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
5 | 0.25 mL | 浅黄色 | 无色 |
6 | 0.85 mL | 无色 | 蓝色 |
①对比实验4和5,可以获得的结论是 。
②用离子方程式解释实验6的现象: 。
【答案】(1)ClO3-+6I-+6H+=Cl-+3I2+3H2O(2)①c
②排除易升华的I2对湿润淀粉KI试纸检验Cl2的干扰 2ClO3-+I2=Cl2↑+2IO3-
(3)①ClO3-和I-的反应规律与H+(或H2SO4)的用量有关
②6ClO3-+5I-+6H+=3Cl2↑+5IO3-+3H2O
【解析】
试题分析:(1)白色沉淀是AgCl,说明反应中有氯离子生成,因此氯酸钠的还原产物是氯离子,所以溶液中ClO3-和I-发生反应的离子方程式为ClO3-+ 6I-+ 6H+=Cl-+ 3I2 + 3H2O。
(2)①溶液由无色变为黄色,说明有碘单质生成,因此说明溶液中的碘酸根被还原为单质碘,选项中只有亚硫酸钠能被碘酸钾氧化,答案选c;
②由于碘易升华,所以进行以上对比实验的目的是排除易升华的I2对湿润淀粉KI试纸检验Cl2的干扰;根据以上分析可知NaClO3溶液用量增加导致溶液褪色的原因是由于氯酸根被生成的碘还原,而碘被氧化为碘酸根,反应的离子方程式为2ClO3- + I2=Cl2↑+ 2IO3-。
(3)①对比实验4和5中的实验现象可以获得的结论是ClO3-和I-的反应规律与H+(或H2SO4)的用量有关。②试管中溶液颜色是无色,说明没有碘生成,二淀粉碘化钾试纸变蓝色,说明有碘生成,因此反应中有氯气产生,将碘化钾氧化,所以反应的离子方程式为6ClO3- + 5I- + 6H+ =3Cl2↑ + 5IO3-+ 3H2O。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案