题目内容
【题目】下列实验能达到目的的是( )
A.用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
B.用NaOH溶液与FeCl3溶液制备Fe(OH)3胶体
C.用品红和盐酸检验Na2SO3和Na2CO3
D.将混有乙烯的SO2通入酸性KMnO4溶液中除去乙烯
【答案】C
【解析】A项,乙酸乙酯中的少量乙酸应该用饱和Na2CO3溶液除去,错误;B项,NaOH溶液与FeCl3溶液反应得到Fe(OH)3沉淀,应把饱和FeCl3溶液滴加到沸水中,再加热到红褐色得到FeCl3胶体。

【题目】下列有关实验的操作正确的是( )
实验 | 操作 | |
A. | 配制稀硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
B. | 排水法收集KMnO4分解产生的O2 | 先熄灭酒精灯,后移出导管 |
C. | 浓盐酸与MnO2反应制备纯净Cl2 | 气体产物先通过浓硫酸,后通过饱和食盐水 |
D. | CCl4萃取碘水中的I2 | 先从分液漏斗下口放出有机层,后从上口倒出水层 |
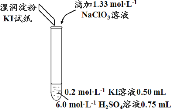
【题目】某实验小组同学模拟工业制碘的方法,探究ClO![]() 和I
和I![]() 的反应规律。实验操作及现象如下:
的反应规律。实验操作及现象如下:
实验及试剂 | 编号 | 无色NaClO3 溶液用量 | 试管中 溶液颜色 | 淀粉KI 试纸颜色 |
| 1 | 0.05 mL | 浅黄色 | 无色 |
2 | 0.20 mL | 深黄色 | 无色 | |
3 | 0.25 mL | 浅黄色 | 蓝色 | |
4 | 0.30 mL | 无色 | 蓝色 |
(1)取实验2后的溶液,进行如下实验:
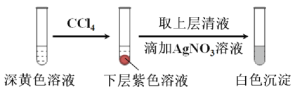
经检验,上述白色沉淀是AgCl。写出加入0.20 mL NaClO3后,溶液中ClO3-和I-发生反应的离子方程式: 。
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-。
作出假设: NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)中的反应产物继续反应,同时生成Cl2。
进行实验:
①取少量实验4中的无色溶液进行以下实验,进一步佐证其中含有IO3-。
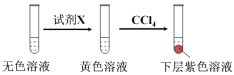
其中试剂X可以是 (填字母序号)。
a.碘水 b.MnO4溶液 c.NaHSO3溶液
② 有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2,便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30 mL 1.33 mol·L1 NaClO3溶液后,发现湿润的淀粉试纸没有明显变化。进行以上对比实验的目的是 ,进一步佐证实验4中生成了Cl2。
获得结论:NaClO3溶液用量增加导致溶液褪色的原因是 (用离子方程式表示)。
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如下实验结果:
编号 | 6.0 mol·L1 H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
5 | 0.25 mL | 浅黄色 | 无色 |
6 | 0.85 mL | 无色 | 蓝色 |
①对比实验4和5,可以获得的结论是 。
②用离子方程式解释实验6的现象: 。
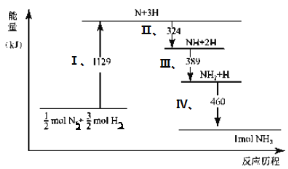
【题目】在100℃时,将0.40 mol NO2气体充入2 L的密闭容器中,发生如下反应:2NO2(g) ![]() N2O4(g) H < 0。监测反应获得如下数据:
N2O4(g) H < 0。监测反应获得如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
下列说法正确的是
A.0~20 s内,v(NO2) = 0.005 mol·L-1.s-1
B.59 s时,c(NO2)一定大于0.12 mol·L-1
C.若仅将起始时充入NO2的量增至0.80 mol,则该反应的平衡常数K > 25/9
D.若上述反应在120℃时进行,则反应至80 s时,n(N2O4) < 0.08 mol