题目内容
【题目】汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)![]() 2NO(g)ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g)ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率为_________________。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡状态的标志__________。
A.消耗1 mol N2同时生成1 mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v正(N2)=v逆(NO)
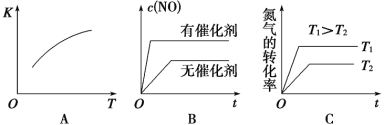
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,右图变化趋势正确的是________(填字母序号)。
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数________。(填“变大”、“变小”或“不变”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol/L、4.0×10-2 mol/L和3.0×10-3 mol/L,此时反应_____________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是_______________。
【答案】(1)0.05mol/(L.min);
(2)AD;(3)AC;(4)不变;
(5)正反应方向进行,因为浓度商Qc<K
【解析】
试题分析:(1)5分钟内,△n(O2)=1mol-0.5mol=0.5mol,由N2(g)+O2(g)2NO(g)可知△n(N2)=0.5mol,v(N2)= ![]() =
=![]() =0.05mol/(Lmin),故答案为:0.05mol/(Lmin);
=0.05mol/(Lmin),故答案为:0.05mol/(Lmin);
(2)A.消耗1mol N2等效于消耗1mol O2,同时生成1mol O2,故选;B.混合气体密度一直不变,故不选;C.混合气体平均相对分子质量不变,总质量是个定值,总物质的量是个定值,混合气体的平均相对分子质量一直不变,故不选;D.2v(N2)正=v(NO)正=v(NO)逆,故选;故选AD;
(3)A、该反应的正反应为吸热反应,则升高温度平衡向正反应进行,平衡常数增大,故A正确;B、加入催化剂,反应速率增大,但平衡不发生移动,故B错误;C、升高温度,反应速率增大,平衡向正反应方向移动,氮气的转化率增大,故C正确.故答案为:AC;
(4)该反应中,气体的化学计量数之和前后相等,压强对平衡移动没有影响,只要是在相同温度下,则平衡状态相同,与原平衡状态相比,此时平衡混合气中NO的体积分数,故答案为:不变;
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,则有该时刻生成物的浓度幂之积与反应物浓度幂之积的比值为:![]() =9×10-4<K,则反应应向正反应方向进行,故答案为:向正反应方向进行 因为浓度商Qc<K。
=9×10-4<K,则反应应向正反应方向进行,故答案为:向正反应方向进行 因为浓度商Qc<K。

 计算高手系列答案
计算高手系列答案【题目】下列有关实验的操作正确的是( )
实验 | 操作 | |
A. | 配制稀硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
B. | 排水法收集KMnO4分解产生的O2 | 先熄灭酒精灯,后移出导管 |
C. | 浓盐酸与MnO2反应制备纯净Cl2 | 气体产物先通过浓硫酸,后通过饱和食盐水 |
D. | CCl4萃取碘水中的I2 | 先从分液漏斗下口放出有机层,后从上口倒出水层 |
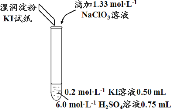
【题目】某实验小组同学模拟工业制碘的方法,探究ClO![]() 和I
和I![]() 的反应规律。实验操作及现象如下:
的反应规律。实验操作及现象如下:
实验及试剂 | 编号 | 无色NaClO3 溶液用量 | 试管中 溶液颜色 | 淀粉KI 试纸颜色 |
| 1 | 0.05 mL | 浅黄色 | 无色 |
2 | 0.20 mL | 深黄色 | 无色 | |
3 | 0.25 mL | 浅黄色 | 蓝色 | |
4 | 0.30 mL | 无色 | 蓝色 |
(1)取实验2后的溶液,进行如下实验:
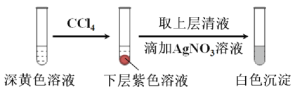
经检验,上述白色沉淀是AgCl。写出加入0.20 mL NaClO3后,溶液中ClO3-和I-发生反应的离子方程式: 。
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-。
作出假设: NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)中的反应产物继续反应,同时生成Cl2。
进行实验:
①取少量实验4中的无色溶液进行以下实验,进一步佐证其中含有IO3-。
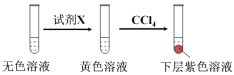
其中试剂X可以是 (填字母序号)。
a.碘水 b.MnO4溶液 c.NaHSO3溶液
② 有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2,便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30 mL 1.33 mol·L1 NaClO3溶液后,发现湿润的淀粉试纸没有明显变化。进行以上对比实验的目的是 ,进一步佐证实验4中生成了Cl2。
获得结论:NaClO3溶液用量增加导致溶液褪色的原因是 (用离子方程式表示)。
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如下实验结果:
编号 | 6.0 mol·L1 H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
5 | 0.25 mL | 浅黄色 | 无色 |
6 | 0.85 mL | 无色 | 蓝色 |
①对比实验4和5,可以获得的结论是 。
②用离子方程式解释实验6的现象: 。
【题目】在100℃时,将0.40 mol NO2气体充入2 L的密闭容器中,发生如下反应:2NO2(g) ![]() N2O4(g) H < 0。监测反应获得如下数据:
N2O4(g) H < 0。监测反应获得如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
下列说法正确的是
A.0~20 s内,v(NO2) = 0.005 mol·L-1.s-1
B.59 s时,c(NO2)一定大于0.12 mol·L-1
C.若仅将起始时充入NO2的量增至0.80 mol,则该反应的平衡常数K > 25/9
D.若上述反应在120℃时进行,则反应至80 s时,n(N2O4) < 0.08 mol