题目内容
加碘食盐中含有的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
(1)步骤②中氢氧化钾的主要作用是 。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,可经过 、过滤、洗涤、干燥等步骤。
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3/100g水 | 8.08 | 12.6 | 18.3 | 24.8 |
(3)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32-=2I-+S4O62-
为了测定加碘食盐中碘的含量,某学生设计了如下实验:准确称取wg食盐,加适量蒸馏水使其完全溶解;再用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;最后加入指示剂,以物质的量浓度为2.00×10-3mol·L-1的Na2S2O3溶液滴定,消耗10.00mL时恰好反应完全。
在滴定过程中,所用的玻璃仪器为 、 。
该实验可以用 作指示剂,滴定终点的现象是 。
③ 下列有关该滴定实验的说法不正确的是 。
A.滴定管在使用前必须检查是否漏水并润洗 B.滴定时眼睛注视滴定管内溶液液面变化
C.为减小实验误差,可用少量的蒸馏水冲洗锥形瓶内壁 D.终点读数时俯视会导致碘的含量偏低
④加碘食盐样品中的碘元素含量是 g·kg-1(以含w的代数式表示)。
(1)与KH(IO3)2反应使其转化为KIO3 (2)蒸发结晶
(3)① 碱式滴定管 锥形瓶 。② 淀粉溶液 溶液的蓝色消失且半分钟内不再变化 ③B ④1.27/3w
解析试题分析:(1)碘单质与氯酸钾在水中发生反应产生KH(IO3)2,加入KOH时可以使之转化为KIO3。(2)由于碘酸钾的溶解度受温度的影响变化不大,所以从KIO3溶液中得到晶体的操作方法是采用蒸发溶剂结晶、过滤、洗涤、干燥等步骤。(3)①由题意可知是用Na2S2O3溶液滴定I2的水溶液。Na2S2O3溶液显碱性所以在滴定过程中,所用的玻璃仪器为碱式滴定管和锥形瓶。②由于单质I2遇淀粉溶液显蓝色。所以可以利用淀粉溶液作指示剂。当达到滴定终点时现象是溶液的蓝色消失且半分钟内不再变化。③A滴定管在使用前必须检查是否漏水并润洗。正确。B滴定时眼睛要注视锥形瓶中溶液颜色的变化。错误。C.可用少量的蒸馏水冲洗锥形瓶内壁,扩大溶液的体积,可以使滴定过程中锥形瓶中物质的浓度减小,这样可以减小实验误差,提高实验的准确度。正确。D.终点读数时若俯视会导致滴定所用Na2S2O3溶液的体积偏小,以此为标准计算的碘的含量就偏低。正确。故有关该滴定实验的说法不正确的是B。④由方程式KIO3+5KI+3H2SO4= 3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-可得关系式KIO3—— 3I2 —— 6S2O32-.n(Na2S2O3)=2.00×10-5mol.所以n(KIO3)=1/3×10-5mol.所以碘元素的质量为1/3×10-5mol ×127g/mol =1.27/3×10-3g.所以该加碘食盐样品中的碘元素含量是1.27/3×10-3g÷w×10-3Kg=1.27/3w.
考点:考查滴定法在测定物质组成的应用及滴定终点的判断、指示剂的选择、误差分析等知识。

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案下列叙述错误的是
| A.易燃试剂应与强氧化性试剂分开放置并远离火源 |
| B.某溶液中加入盐酸,有白色沉淀生成,说明原溶液中一定存在Ag+ |
| C.用50 mL酸式滴定管可准确量取25.00 mL的KMnO4溶液 |
| D.氢氧化铁胶体加热蒸干、灼烧后有氧化铁生成 |
下列叙述正确的是( )
①装置甲可防止铁钉生锈
②装置乙可除去乙烯中混有的乙炔
③装置丙可验证HCl气体在水中的溶解性
④装置丁可用于实验室制取乙酸乙酯
⑤装置戊既可用于收集H2、CO2、Cl2和HCl气体,也可用于干燥H2、CO2、Cl2和HCl气体。
| A.①⑤ | B.④⑤ | C.①② | D.③⑤ |
工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
已知:①Li2O·Al2O3·4SiO2 H2SO4(浓)
H2SO4(浓) Li2SO4
Li2SO4 Al2O3·4SiO2·H2O↓
Al2O3·4SiO2·H2O↓
②某些物质的溶解度(S)如下表所示:
| T/℃ | 20 | 40 | 60 | 80 |
 (Li2CO3)/g (Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
 (Li2SO4)/g (Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
③从滤渣1中提取出Si的部分流程如下图所示:

根据以上信息,请回答下列问题:
(1)括号内应提供的相应条件和物质 、 。
(2)方框中所得物质的化学式 。
(3)使用浓硫酸并加热到250℃~300℃的目的是 。
(4)②处加Na2CO3溶液所发生反应的离子方程式 、 。
(5)滤渣2的主要成分有 。
(6)如何检验Li2CO3是否洗涤干净? 。
有关钴和铁化合物的性质见下表:
| 化学式 | 溶度积(室温时)Ksp | 沉淀完全时的pH | 氯化钴晶体的性质 |
| Co(OH) 2 | 5.9×10-15 | 9.4 | CoCl2·6H2O呈红色,常温下稳定。110ºC~120ºC时脱水变成蓝色无水氯化钴 |
| Fe(OH) 2 | 1.6×10-14 | 9.6 | |
| Fe(OH) 3 | 1.0×10-35 | x |
用含钴废料(含少量铁)可制备氯化钴:Co+2HCl=CoCl2+H2↑工艺流程如下:
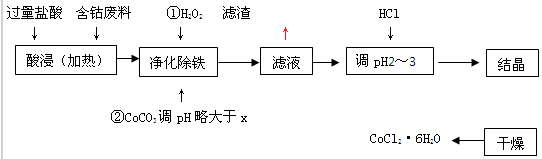
试回答:
(1)“净化除铁”中,写出加入CoCO3(难溶)调pH时反应的离子方程式
(2)滤液中(Fe3+)≤1.0×10-5mol/L时,可视为Fe3+沉淀完全。试计算室温下,Fe(OH) 3沉淀完全时,则x= 。
(3)②步中用CoCO3调pH略大于x的原因是 。
(4)滤液中所含溶质有 , 。
(5)为了防止CoCl2·6H2O脱水,“干燥”时宜采用的方法或操作是 , 。
(15分)
某化学兴趣小组的同学为制取少量溴乙烷,查阅资料得知:
NaBr+H2SO4 HBr+NaHSO4
HBr+NaHSO4
CH3CH2OH+HBr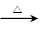 CH3CH2Br+H2O
CH3CH2Br+H2O
化学兴趣小组根据实验原理设计如右图的装置。
根据题意完成下列填空:有关数据列表如下:
| | 乙醇 | 溴乙烷 |
| 状态 | 无色液体 | 无色液体 |
| 密度/g · cm-3 | 0.8 | 1.4 |
| 沸点/℃ | 78.5 | 119.0 |
| 熔点/℃ | -l30 | 38.4 |
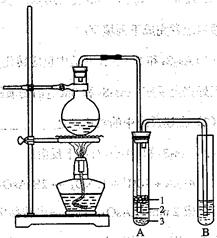
(1)圆底烧瓶中加入的反应物是溴化钠、 和2:1的硫酸。配制体积比2:1的硫酸所用的仪器为 (选填编号)
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶 e.滴定管
(2)将生成物导入盛有冰水混合物的试管A中,试管A中的物质分为三层(如图所示),产物在第
层;
(3)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质应加
入 (选填编号)然后再进行 一步操作即可;
a.无水氯化钙 b.硝酸银溶液 c.四氯化碳 d.亚硫酸钠溶液
(4)实验过程中,同学发现仪器连接部分有漏气现象,老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是: ;
(5)假设最初取用的无水乙醇是57.5mL,最后得到的纯净的溴乙烷是52.0mL,则溴乙烷的产率为 。
实验需要0.1 mol/L NaOH溶液450 mL,根据溶液配制中的情况回答下列问题:
(1)实验中除了托盘天平、烧杯、容量瓶外还需要的其他仪器有___ ___
_______________________________________________ __________。
(2)根据计算得知,所需NaOH的质量为________g。
(3)配制一定物质的量浓度溶液的实验中,如果出现以下操作
| A.称量时用了生锈的砝码 |
| B.将NaOH放在纸张上称量 |
| C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中 |
| D.往容量瓶转移时,有少量液体溅出 |
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
对配制的溶液物质的量浓度大小可能造成的影响是(填写字母)偏大的有________。