��Ŀ����
�������е�����ѧ��ѧʵ�����м��ֳ����IJ���������
���¶ȼơ�������ƿ���۵ζ��ܡ����ձ�����Բ����ƿ������Ͳ���߲�����
(1)�������ϱ�������ʹ���¶ȵ���(�������¶ȼ�)_______(��д���)��������Ӧ�������ɼ��ȵ���________(��д���)��
(2)��Ҫ���¶ȼƵ�ʵ����________(��д���)��
��ʯ�ͷ���Ũ����ϡ�͡��۲ⶨ����ص��ܽ��
(3)��������������Ҫ���������֡���ͬʵ���������ÿ��ܲ���ȫ��ͬ����ش��������⣺
�ٽ��衡����������պȡ��Һ
A���ڡ�����ˮ̼��������100 mL 0.12 mol��L��1��̼������Һ����ʵ���У���������������________(��д���)��
B���ڡ�������������Һ��̼������Һ���Ȼ�����Һ�����ᡢˮ���Լ���ȥ�����е�Mg2����Ca2����SO42-�����������Ի�ô�����ʳ�Ρ���ʵ���в����������ÿ�����________(��д���)��
(1)�ڢۢޡ��ܢݡ�(2)�٢ۡ�(3)A.�٢ڡ�B���٢ڢ�
����

 �¿α�ͬ��ѵ��ϵ�д�
�¿α�ͬ��ѵ��ϵ�д� һ����ʦ����Ӧ����������һ��ȫϵ�д�
һ����ʦ����Ӧ����������һ��ȫϵ�д� Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д�������ʵ��װ��ͼ��˵����ȷ����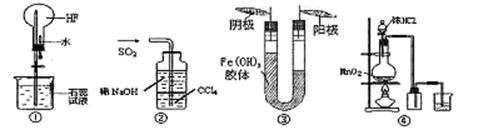
| A������ͼ��װ������Ȫʵ�� |
| B������ͼ��װ������β��SO2 |
| C������ͼ��װ�ý��н����Ӿʵ�����˵��Fe��OH��3���������� |
| D������ͼ��װ����MnO2��Ũ�����Ʊ����ռ�Cl2 |
���������У����þƾ���ֱ�Ӽ��ȵ���
| A���ձ� | B����ƿ | C����ƿ | D������ |
��16�֣���1�������й�ʵ��������жϲ���ȷ���� ��
| A������һ�����ʵ���Ũ����Һ������ʱ���ӿ̶��ᵼ��������ҺŨ��ƫС |
| B���ø����pH��ֽ�ⶨ��ˮ��pH |
| C������ϡ����ʱ���������ձ��м���һ�����������ˮ���ٱ�������Ũ����߽��� |
| D������ƽ���������и���һ�Ű�ֽ���ɽ�NaOH������ڰ�ֽ�ϳ��� |
F���Ʊ�����������ʱ����ʢ��NaOH��Һ�ĵιܣ���������������Һ��
��2�����ӣ�������Ϊ���ʣ�����������Լ����й����ӷ�Ӧ����ʽ���ڿհ״���
| | �Լ� | ���ӷ�Ӧ����ʽ |
| ��NaHCO3��Һ��Na2CO3�� | | |
| �� Fe2O3��Al2O3�� | | |
| ��FeCl3��Һ��FeCl2�� | | |
| ��CO2��HCl�� | | |
�ӵ�ʳ���к��еĵ������һ�ְ�ɫ�ᾧ��ĩ�������º��ȶ���������560�濪ʼ�ֽ⡣�����������µ������һ�ֽ�ǿ��������������⻯��������εȻ�ԭ�����ʷ�Ӧ����ҵ��������ص��������£�
��1����������������ص���Ҫ������ ��
��2�������±�����ص��ܽ�ȣ������۵õ�����ؾ��壬�ɾ��� �����ˡ�ϴ�ӡ�����Ȳ��衣
| �¶�/�� | 20 | 40 | 60 | 80 |
| KIO3/100gˮ | 8.08 | 12.6 | 18.3 | 24.8 |
��3����֪��KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O�� I2+2S2O32-=2I-+S4O62-
Ϊ�˲ⶨ�ӵ�ʳ���е�ĺ�����ijѧ�����������ʵ�飺ȷ��ȡwgʳ�Σ�����������ˮʹ����ȫ�ܽ⣻����ϡ�����ữ������Һ���������KI��Һ��ʹKIO3��KI��Ӧ��ȫ��������ָʾ���������ʵ���Ũ��Ϊ2.00��10-3mol��L-1��Na2S2O3��Һ�ζ�������10.00mLʱǡ�÷�Ӧ��ȫ��
�ڵζ������У����õIJ�������Ϊ �� ��
��ʵ������� ��ָʾ�����ζ��յ�������� ��
�� �����йظõζ�ʵ���˵������ȷ���� ��
A���ζ�����ʹ��ǰ�������Ƿ�©ˮ����ϴ B���ζ�ʱ�۾�ע�ӵζ�������ҺҺ��仯
C��Ϊ��Сʵ������������������ˮ��ϴ��ƿ�ڱ� D���յ����ʱ���ӻᵼ�µ�ĺ���ƫ��
�ܼӵ�ʳ����Ʒ�еĵ�Ԫ�غ����� g��kg-1���Ժ�w�Ĵ���ʽ��ʾ����
��������������Ҫ��Fe2O3��SiO2��Al2O3��MgO�����ʣ��Ʊ��������Ĺ����������£�
��1���������������Ҫ�ʵ�������Ŀ���Ǣ�������Ľ����ʣ��� ��
��2������ԭ���ǽ�Fe3��ת��ΪFe2����ͬʱFeS2������ΪSO42�����÷�Ӧ�����ӷ���ʽΪ ��
��3��Ϊ�ⶨ��������������Һ��Fe3�������Կ��Ƽ���FeS2������ʵ�鲽��Ϊ��ȷ��ȡһ���������������Һ����ƿ�У�����HCl���Թ���SnCl2���ټ�HgCl2��ȥ������SnCl2���Զ�����������Ϊָʾ������K2Cr2O7����Һ�ζ����йط�Ӧ����ʽ���£�
2Fe3����Sn2����6Cl����2Fe2����SnCl62����
Sn2����4Cl����2HgCl2��SnCl62����Hg2Cl2����
6Fe2����Cr2O72����14H����6Fe3����2Cr3����7H2O��
����SnCl2����������ⶨ��Fe3���� ���ƫ�ߡ�����ƫ�͡��������䡱����ͬ����
��������HgCl2����ⶨ��Fe3���� ��
��4���ٿ�ѡ�� �����Լ���������Һ�к���Fe3+������Fe3+��ԭ���� �������ӷ�Ӧ����ʽ��ʾ����
����֪����������������������ʽ����ʱ��Һ��pH���±���
| ������ | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| ��ʼ���� | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| ��ȫ���� | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
ʵ���ѡ�õ��Լ��У�ϡHNO3��Ba(NO3)2��Һ������KMnO4��Һ��NaOH��Һ��Ҫ���Ʊ������в������ж����塣
������ɡ����ˡ������Һģ���Ʊ���������ʵ�鲽�裺
a.������ ��
b.������ ��
c.���룬ϴ�ӣ�
d.��ɣ���ĥ��
����ͭ�����ڲ�ͬ�¶��¿�ʧȥ���ֻ�ȫ���ᾧˮ�����ֽ�������ijѧ���ڲ�ͬ�¶��¸�8.000 g����ͭ������ȣ��¶������ߣ���ʵ������¼���£�
| ʵ����� | �¶ȣ��棩 | ��ȴ��ʣ������������g�� |
| 1 | 102 | 6.848 |
| 2 | 113 | 5.696 |
| 3 | 258 | 5.120 |
| 4 | 570 | 2.560 |
��1����1��ʵ�����������ʧȥ�ᾧˮ��������_____ g��
��2��ͨ������ȷ���ڶ���ʵ���������ʵĻ�ѧʽΪ______________��
��3�����Ĵ�ʵ���ʣ�����Ϊһ�ֺ�ɫ��ĩ������Ϊ����������ú�ɫ��ĩ�ܽ���ϡ�����У�������Ҫ0.50mol/L��ϡ������ٺ�������д��������̣�
