题目内容
为了测定含有H2C2O4·2H2O、KHC2O4和K2SO4的试样中各物质的质量分数,进行如下实验:
①称取6.0 g试样,加水溶解,配成250 mL试样溶液。
②用酸式滴定管量取25.00 mL试样溶液放入锥形瓶中,并加入2~3滴酚酞试液,用0.2500 mol/L NaOH溶液滴定,消耗NaOH溶液20.00 mL。
③再取25.00 mL试样溶液放入另一锥形瓶中,用0.1000 mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液16.00 mL。
回答下列问题:
(1)已知:0.10 mol/L KHC2O4溶液pH约为3,其中含碳元素的粒子浓度由大到小的顺序为 。
(2)步骤①所需要的玻璃仪器有烧杯、玻璃棒、 。
(3)完成并配平下列离子方程式: C2O42-+ MnO4-+ H+= CO2+ Mn2++
(4)滴定时边滴边摇动锥形瓶,眼睛应观察 。
(5)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的H2C2O4·2H2O的质量分数 。(填“偏大”、“偏小”或“无影响”)
(6)步骤③中判断滴定终点的方法是 。
(7)试样中H2C2O4·2H2O的质量分数为 。
(12分) (1) c(HC2O4-)>c(C2O42-)>c(H2C2O4) (2分)
(2)胶头滴管、250 mL容量瓶(2分)、(量筒)
(3) 5,2,16 10,2,8H2O(2分) (4) 锥形瓶中溶液颜色变化(1分)
(5) 偏小(1分) (6) 溶液由无色变成浅紫红色,且半分钟内不褪色(1分) (7) 21%(3分)
解析试题分析:(1)已知0.10 mol/L KHC2O4溶液pH约为3,溶液显酸性,这说明HC2O4-的电离程度大于HC2O4-的水解程度。由于不论是水解,还是电离,程度都是很小的,所以溶液中含碳元素的粒子浓度由大到小的顺序为c(HC2O4-)>c(C2O42-)>c(H2C2O4)。
(2)实验室配成250 mL试样溶液需要的仪器主要有烧杯、玻璃棒、胶头滴管和250ml容量瓶。
(3)根据反应式可知,C2O42-中碳元素的化合价从+3价升高到+4价,失去1个电子。MnO4-中Mn元素的化合价从+7价降低到+2价,得到5个电子,所以根据电子得失守恒可知,还原剂C2O42-与氧化剂MnO4-的物质的量之比是5:2,然后根据原子守恒可知,反应中还有水生成,所以配平后的离子方程式为5C2O42-+2MnO4-+16H+=10CO2+2Mn2++8H2O。
(4)滴定实验中准确判断终点是实验的关键,所以滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶中溶液颜色变化。
(5)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则导致溶液额浓度被稀释,所以消耗氢氧化钠溶液的体积减少,所以测得的H2C2O4·2H2O的质量分数偏小。
(6)由于酸性高锰酸钾溶液在溶液中显紫红色,所以步骤③中判断滴定终点的方法是溶液由无色变成浅紫红色,且半分钟内不褪色。
(7)设H2C2O4·2H2O、KHC2O4的物质的量分别是x 和y。25ml溶液消耗氢氧化钠的物质的量=0.02000L×0.2500 mol/L=0.005000mol,则250ml溶液消耗氢氧化钠的物质的量=0.005000mol×10=0.05000mol,则2x+y=0.05000mol。25ml溶液消耗高锰酸钾的物质的量=0.1000 mol/L×0.01600L=0.001600mol,所以250ml溶液消耗高锰酸钾的物质的量=0.001600mol×10=0.01600mol,则根据电子得失守恒可知,2x+2y=0.01600mol×5=0.08000mol,解得x=0.01000mol、y=0.03000mol,所以试样中H2C2O4·2H2O的质量分数为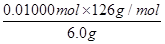 ×100%=21%。
×100%=21%。
考点:考查溶液中离子浓度大小比较;一定物质的量浓度配制;滴定实验判断和误差分析;氧化还原反应方程式的配平;物质含量的测定和计算

(16分)(1)下列有关实验操作或判断不正确的是 。
| A.配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏小 |
| B.用干燥的pH试纸测定氯水的pH |
| C.配制稀硫酸时,可先在烧杯中加入一定体积的蒸馏水,再边缓慢加入浓硫酸边搅拌 |
| D.在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量 |
F.制备氢氧化亚铁时,将盛有NaOH溶液的滴管,伸入硫酸亚铁溶液中
(2)除杂(括号内为杂质):请把所加试剂和有关离子反应方程式填在空白处。
| | 试剂 | 离子反应方程式 |
| ①NaHCO3溶液(Na2CO3) | | |
| ② Fe2O3(Al2O3) | | |
| ③FeCl3溶液(FeCl2) | | |
| ④CO2(HCl) | | |
加碘食盐中含有的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
(1)步骤②中氢氧化钾的主要作用是 。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,可经过 、过滤、洗涤、干燥等步骤。
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3/100g水 | 8.08 | 12.6 | 18.3 | 24.8 |
(3)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32-=2I-+S4O62-
为了测定加碘食盐中碘的含量,某学生设计了如下实验:准确称取wg食盐,加适量蒸馏水使其完全溶解;再用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;最后加入指示剂,以物质的量浓度为2.00×10-3mol·L-1的Na2S2O3溶液滴定,消耗10.00mL时恰好反应完全。
在滴定过程中,所用的玻璃仪器为 、 。
该实验可以用 作指示剂,滴定终点的现象是 。
③ 下列有关该滴定实验的说法不正确的是 。
A.滴定管在使用前必须检查是否漏水并润洗 B.滴定时眼睛注视滴定管内溶液液面变化
C.为减小实验误差,可用少量的蒸馏水冲洗锥形瓶内壁 D.终点读数时俯视会导致碘的含量偏低
④加碘食盐样品中的碘元素含量是 g·kg-1(以含w的代数式表示)。
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
(1)“酸浸”中硫酸要适当过量,目的是①提高铁的浸出率,② 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量 (填“偏高”、“偏低”、“不变”,下同),
②若不加HgCl2,则测定的Fe3+量 。
(4)①可选用 (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是 (用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。
请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化: ;
b.沉淀: ;
c.分离,洗涤;
d.烘干,研磨。


 ×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。