题目内容
工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
已知:①Li2O·Al2O3·4SiO2 H2SO4(浓)
H2SO4(浓) Li2SO4
Li2SO4 Al2O3·4SiO2·H2O↓
Al2O3·4SiO2·H2O↓
②某些物质的溶解度(S)如下表所示:
| T/℃ | 20 | 40 | 60 | 80 |
 (Li2CO3)/g (Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
 (Li2SO4)/g (Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
③从滤渣1中提取出Si的部分流程如下图所示:

根据以上信息,请回答下列问题:
(1)括号内应提供的相应条件和物质 、 。
(2)方框中所得物质的化学式 。
(3)使用浓硫酸并加热到250℃~300℃的目的是 。
(4)②处加Na2CO3溶液所发生反应的离子方程式 、 。
(5)滤渣2的主要成分有 。
(6)如何检验Li2CO3是否洗涤干净? 。
(1)加热或高温(1分) C和高温 (2分) (2) SiO2 (1分)
(3)减少杂质的溶解、提高Li2SO4的浸出率、加快浸出速率(每项1分,共2分,任意两项均得2分,其它合理答案也可)
(4) Ca2+ + CO32- = CaCO3↓(1分) CaSO4 + CO32- = CaCO3 + SO42- (2分)
(5) Mg(OH)2和CaCO3 (每个1分,共2分)
(6)取最后一次洗涤液少许于试管中,先在其中加入足量稀盐酸,然后滴入几滴BaCl2溶液,若未出现白色沉淀,则洗涤干净,反之则不干净。(其它合理答案也可,2分)
解析试题分析:H4SiO4加热生成SiO2,SiO2与C在高温条件下反应生成单质Si和CO,所以(1)括号内相应条件和物质分别为加热、C和高温;(2)方框中物质为H4SiO4加热分解的产物:SiO2。
(3)使用浓硫酸并加热到250℃~300℃的目的是减少杂质的溶解、提高Li2SO4的浸出率、加快浸出速率。
(4)加入H2SO4后生成CaSO4,CaSO4微溶,含Ca2+和CaSO4固体,所以加入Na2CO3反应的离子方程式为:Ca2+ +CO32- =CaCO3↓、CaSO4+CO32- =CaCO3+SO42?。
(5)加入Ca(OH)2和Na2CO3后,OH?与溶液中的Mg2+反应,Ca2+与CO32?反应,所以滤渣2的主要成分为Mg(OH)2和CaCO3。
(6)假如Li2CO3没有洗涤干净,表面会沾附Na2SO4溶液,所以用稀盐酸和BaCl2溶液进行检验。
考点:本题考查化学工艺流程的分析、离子方程式的书写、沉淀是否洗涤干净的方法。

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案下列实验正确的是
| A.用量筒量取15.50mL 0.100 mol·L-1盐酸 |
| B.用无水酒精萃取碘水中的碘 |
| C.用过量浓氨水洗涤试管内的银镜 |
| D.做H2还原CuO实验时,要先通氢气,验纯后再加热 |
下列关于容量瓶及其使用方法的叙述,正确的是( )
①是配制一定物质的量浓度的溶液的专用仪器 ②使用前要先检查容量瓶是否漏液
③容量瓶可以用来加热 ④不能用容量瓶贮存配制好的溶液
⑤一定要用500mL容量瓶配制250mL溶液
| A.①③ | B.①②④ | C.①②④⑤ | D.①②③④ |
(16分)(1)下列有关实验操作或判断不正确的是 。
| A.配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏小 |
| B.用干燥的pH试纸测定氯水的pH |
| C.配制稀硫酸时,可先在烧杯中加入一定体积的蒸馏水,再边缓慢加入浓硫酸边搅拌 |
| D.在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量 |
F.制备氢氧化亚铁时,将盛有NaOH溶液的滴管,伸入硫酸亚铁溶液中
(2)除杂(括号内为杂质):请把所加试剂和有关离子反应方程式填在空白处。
| | 试剂 | 离子反应方程式 |
| ①NaHCO3溶液(Na2CO3) | | |
| ② Fe2O3(Al2O3) | | |
| ③FeCl3溶液(FeCl2) | | |
| ④CO2(HCl) | | |
加碘食盐中含有的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
(1)步骤②中氢氧化钾的主要作用是 。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,可经过 、过滤、洗涤、干燥等步骤。
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3/100g水 | 8.08 | 12.6 | 18.3 | 24.8 |
(3)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32-=2I-+S4O62-
为了测定加碘食盐中碘的含量,某学生设计了如下实验:准确称取wg食盐,加适量蒸馏水使其完全溶解;再用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;最后加入指示剂,以物质的量浓度为2.00×10-3mol·L-1的Na2S2O3溶液滴定,消耗10.00mL时恰好反应完全。
在滴定过程中,所用的玻璃仪器为 、 。
该实验可以用 作指示剂,滴定终点的现象是 。
③ 下列有关该滴定实验的说法不正确的是 。
A.滴定管在使用前必须检查是否漏水并润洗 B.滴定时眼睛注视滴定管内溶液液面变化
C.为减小实验误差,可用少量的蒸馏水冲洗锥形瓶内壁 D.终点读数时俯视会导致碘的含量偏低
④加碘食盐样品中的碘元素含量是 g·kg-1(以含w的代数式表示)。
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一 滴定法 用酸性KMnO4溶液滴定测定铁元素的含量。
反应原理:5Fe2++MnO4—+8H+===5Fe3++Mn2++4H2O
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需________(填仪器名称)。
(2)上述实验中KMnO4溶液需要酸化,用于酸化的酸是________。
| A.稀硫酸 | B.浓硝酸 | C.稀硝酸 | D.稀盐酸 |
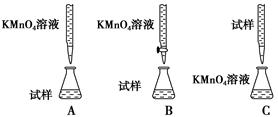
方案二 重量法 操作流程如下:

(4)步骤②中除用H2O2外还可以使用的物质是__________________________。
(5)步骤②是否可以省略________,理由是________________________________
_______________________________________。
(6)步骤④中一系列操作依次是:过滤、洗涤、________、冷却、称量。
(7)假设实验无损耗,则每片补血剂含铁元素的质量________g(用含a的代数式表示)。

 ×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。