题目内容
(15分)
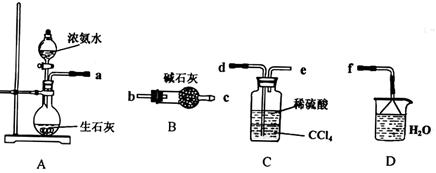
某化学兴趣小组的同学为制取少量溴乙烷,查阅资料得知:
NaBr+H2SO4 HBr+NaHSO4
HBr+NaHSO4
CH3CH2OH+HBr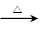 CH3CH2Br+H2O
CH3CH2Br+H2O
化学兴趣小组根据实验原理设计如右图的装置。
根据题意完成下列填空:有关数据列表如下:
| | 乙醇 | 溴乙烷 |
| 状态 | 无色液体 | 无色液体 |
| 密度/g · cm-3 | 0.8 | 1.4 |
| 沸点/℃ | 78.5 | 119.0 |
| 熔点/℃ | -l30 | 38.4 |
(1)圆底烧瓶中加入的反应物是溴化钠、 和2:1的硫酸。配制体积比2:1的硫酸所用的仪器为 (选填编号)
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶 e.滴定管
(2)将生成物导入盛有冰水混合物的试管A中,试管A中的物质分为三层(如图所示),产物在第
层;
(3)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质应加
入 (选填编号)然后再进行 一步操作即可;
a.无水氯化钙 b.硝酸银溶液 c.四氯化碳 d.亚硫酸钠溶液
(4)实验过程中,同学发现仪器连接部分有漏气现象,老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是: ;
(5)假设最初取用的无水乙醇是57.5mL,最后得到的纯净的溴乙烷是52.0mL,则溴乙烷的产率为 。
(1)无水乙醇(2分),abc(3分) (2)3 (2分)
(3)d(2分),分液 (2分) (4)反应会产生Br2,腐蚀橡胶(2分) (5)66.8%(2分)
解析试题分析:(1)根据题目所给信息,反应物还需要有无水乙醇,所以圆底烧瓶中加入的反应物除了NaBr和硫酸,还要加入无水乙醇;配制体积比2:1的硫酸需要量筒量取浓硫酸和水的同体积,需要在烧杯中溶解,并用玻璃杯搅拌,故答案为abc。
(2)溴乙烷的密度最大,在最底层,即第3层。
(3)试管A中获得的有机物呈棕黄色,说明生成了Br2,Br2具有氧化性,可用亚硫酸钠溶液除去;Br2与亚硫酸钠溶液反应的生成物均溶于水,所以通过分液即可完成除杂。
(4)浓硫酸氧化Br?生成Br2,Br2具有腐蚀性,能腐蚀橡胶,所以把器连接部分都改成标准玻璃接口。
考点:本题考查实验基本仪器和基本操作、实验方案的分析、化学计算。

 单元期中期末卷系列答案
单元期中期末卷系列答案下列仪器中,可用酒精灯直接加热的是
| A.烧杯 | B.烧瓶 | C.锥形瓶 | D.坩埚 |
加碘食盐中含有的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
(1)步骤②中氢氧化钾的主要作用是 。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,可经过 、过滤、洗涤、干燥等步骤。
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3/100g水 | 8.08 | 12.6 | 18.3 | 24.8 |
(3)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32-=2I-+S4O62-
为了测定加碘食盐中碘的含量,某学生设计了如下实验:准确称取wg食盐,加适量蒸馏水使其完全溶解;再用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;最后加入指示剂,以物质的量浓度为2.00×10-3mol·L-1的Na2S2O3溶液滴定,消耗10.00mL时恰好反应完全。
在滴定过程中,所用的玻璃仪器为 、 。
该实验可以用 作指示剂,滴定终点的现象是 。
③ 下列有关该滴定实验的说法不正确的是 。
A.滴定管在使用前必须检查是否漏水并润洗 B.滴定时眼睛注视滴定管内溶液液面变化
C.为减小实验误差,可用少量的蒸馏水冲洗锥形瓶内壁 D.终点读数时俯视会导致碘的含量偏低
④加碘食盐样品中的碘元素含量是 g·kg-1(以含w的代数式表示)。
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
(1)“酸浸”中硫酸要适当过量,目的是①提高铁的浸出率,② 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量 (填“偏高”、“偏低”、“不变”,下同),
②若不加HgCl2,则测定的Fe3+量 。
(4)①可选用 (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是 (用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。
请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化: ;
b.沉淀: ;
c.分离,洗涤;
d.烘干,研磨。
硫代硫酸钠的纯度可用滴定法进行测定,原理是:2S2O32-+ I2 → S4O62-+ 2I-
38.配制100 mL0.0500 mol/L I2溶液,不需要的仪器是 (选填编号)。
a.100 mL容量瓶 b.量筒 c.烧杯 d.玻璃棒
滴定管标有使用温度:20oC; 滴定管的最小刻度为 mL。
39.取2 .500g含杂质的Na2S2O3·5H2O晶体配成50mL溶液,每次取10.00mL放入锥形瓶里,加2滴淀粉为指示剂,再用0.0500 mol/L I2溶液滴定,实验数据如下(第3次初读数为 0.00,终点读数如图; 杂质不参加反应):
| 编号 | 1 | 2 | 3 |
| 消耗I2溶液的体积/mL | 19.98 | 20.02 | |
Na2S2O3?5H2O(式量248)的质量分数是(保留4位小数) 。
40.会造成实验结果偏低的操作是 (选填编号)。
a. 滴定时滴定管中的液体滴在锥形瓶外
b. 锥形瓶用蒸馏水洗净后,立即装入待测溶液
c. 未用标准液润洗滴定管
d. 振荡时溶液溅出锥形瓶外
硫酸铜晶体在不同温度下可失去部分或全部结晶水甚至分解成氧化物。某学生在不同温度下给8.000 g硫酸铜晶体加热(温度逐渐升高),实验结果记录如下:
| 实验次序 | 温度(℃) | 冷却后剩余固体的质量(g) |
| 1 | 102 | 6.848 |
| 2 | 113 | 5.696 |
| 3 | 258 | 5.120 |
| 4 | 570 | 2.560 |
(1)第1次实验后,试样晶体失去结晶水的质量是_____ g。
(2)通过计算确定第二次实验后固体物质的化学式为______________。
(3)第四次实验后,剩余固体为一种黑色粉末(假设为纯净物),将该黑色粉末溶解于稀硫酸中,至少需要0.50mol/L的稀硫酸多少毫升?(写出计算过程)

 ×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。