题目内容
下列叙述错误的是
| A.易燃试剂应与强氧化性试剂分开放置并远离火源 |
| B.某溶液中加入盐酸,有白色沉淀生成,说明原溶液中一定存在Ag+ |
| C.用50 mL酸式滴定管可准确量取25.00 mL的KMnO4溶液 |
| D.氢氧化铁胶体加热蒸干、灼烧后有氧化铁生成 |
B
解析试题分析:A、易燃试剂应与强氧化性试剂分开放置并远离火源,以防止发生燃烧爆炸,A正确;B、某溶液中加入盐酸,有白色沉淀生成,白色沉淀可能是氯化银,也可能是硅酸沉淀,因此原溶液中不一定存在Ag+,B不正确;C、酸性高锰酸钾溶液应该用酸式滴定管量取,C正确;D、氢氧化铁胶体加热蒸干得到氢氧化铁固体,氢氧化铁灼烧发生分解反应生成氧化铁和水,D正确,答案选B。
考点:考查试剂的保存、离子的检验、溶液的量取、氢氧化铁胶体的性质等

练习册系列答案
相关题目
从安全的角度考虑,下列说法不正确的是
| A.使用青霉素前,需进行皮肤敏感试验 |
| B.实验室保存苯时,应与氧化剂分开存放 |
| C.苯酚沾到皮肤上,应立即用酒精洗涤 |
| D.金属钠着火时,可用水将其扑灭 |
对以下实验装置图的说法正确的是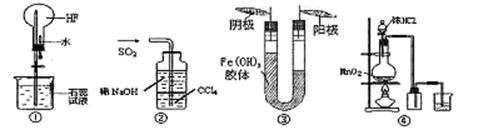
| A.利用图①装置做喷泉实验 |
| B.利用图②装置吸收尾气SO2 |
| C.利用图③装置进行胶体电泳实验可以说明Fe(OH)3胶体带正电荷 |
| D.利用图④装置用MnO2和浓盐酸制备并收集Cl2 |
下列实验正确的是
| A.用量筒量取15.50mL 0.100 mol·L-1盐酸 |
| B.用无水酒精萃取碘水中的碘 |
| C.用过量浓氨水洗涤试管内的银镜 |
| D.做H2还原CuO实验时,要先通氢气,验纯后再加热 |
用下列实验装置进行相应实验,能达到实验目的的是
| A.用图1所示装置分离有机层和水层 |
| B.用图2所示装置从食盐水中提取NaCl |
| C.用图3所示装置用水来吸收HCl |
| D.用图4所示装置收集并检验氨气 |
下列仪器中,可用酒精灯直接加热的是
| A.烧杯 | B.烧瓶 | C.锥形瓶 | D.坩埚 |
加碘食盐中含有的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
(1)步骤②中氢氧化钾的主要作用是 。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,可经过 、过滤、洗涤、干燥等步骤。
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3/100g水 | 8.08 | 12.6 | 18.3 | 24.8 |
(3)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32-=2I-+S4O62-
为了测定加碘食盐中碘的含量,某学生设计了如下实验:准确称取wg食盐,加适量蒸馏水使其完全溶解;再用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;最后加入指示剂,以物质的量浓度为2.00×10-3mol·L-1的Na2S2O3溶液滴定,消耗10.00mL时恰好反应完全。
在滴定过程中,所用的玻璃仪器为 、 。
该实验可以用 作指示剂,滴定终点的现象是 。
③ 下列有关该滴定实验的说法不正确的是 。
A.滴定管在使用前必须检查是否漏水并润洗 B.滴定时眼睛注视滴定管内溶液液面变化
C.为减小实验误差,可用少量的蒸馏水冲洗锥形瓶内壁 D.终点读数时俯视会导致碘的含量偏低
④加碘食盐样品中的碘元素含量是 g·kg-1(以含w的代数式表示)。

