题目内容
16.短周期主族元素A、B、C、D、E、F 的原子序数依次增大,它们的原子核外电子层数之和为13.B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F的最高化合价为+7.试回答以下问题:(1)写出A与D以 1:1的原子个数比形成的化合物的电子式:
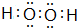 .F的原子结构示意图为:
.F的原子结构示意图为: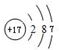 .
.(2)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性.则甲、乙反应的离子方程式为:OH-+HCO3-=CO32-+H2O.
(3)常温下,若将0.2mol/LMOH溶液与0.1mol/LHCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度<MCl的水解程度.(填“>”、“<”、或“无法确定”)
(4)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+)>0.2mol/LHCl溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=9.9×10-7mol/L;
(5)已知500m L 0.1mol/L EDA 溶液与足量A F稀溶液反应,放出热量2.865KJ,试写出此反应的热化学方程式NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol.
分析 短周期主族元素A、B、C、D、E、F 的原子序数依次增大,B形成的化合物种类繁多,则B为C元素;C、D为空气中含量最多的两种元素,D的原子序数较大,则C为N元素,D为O元素;D、E形成两种不同的离子化合物,则E为Na;F的最高化合价为+7,所以F为Cl元素;它们的原子核外电子层数之和为13,则A原子电子层数为13-3-3-2-2-2=1,则A为H元素.
(1)A与D以 1:1的原子个数比形成的化合物为H2O2,氧原子之间形成1对共用电子对,氧原子与氢原子之间形成1对共用电子对;
F为Cl元素,原子核外有17个电子,有3个电子层,各层电子数为2、8、7;
(2)化合物甲、乙由H、C、O、Na中的三种或四种组成,且甲、乙的水溶液均呈碱性,二者可以反应,则甲、乙为氢氧化钠与碳酸氢钠;
(3)常温下,若将0.2mol/LMOH溶液与0.1mol/LHCl溶液等体积混合,混合后为等浓度的MOH、MCl混合溶液,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度小于MCl的水解程度;
(4)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),恰好完全反应得到MCl溶液,测得混合溶液的pH=6,说明得到的盐是强酸弱碱盐:
①混合溶液中由水电离出的c(H+)10-6mol/L,而0.2mol/LHCl溶液中由水电离出的c(H+)=c(OH-);
②根据电荷守恒:c(M+)+c(H+)=c(Cl-)+c(OH-),据此计算;
(5)500m L 0.1mol/L NaOH 溶液与足量HCl稀溶液反应,放出热量2.865KJ,则1molNaOH完全反应放出的热量为:2.865kJ×$\frac{1mol}{0.5L×0.1mol/L}$=57.3kJ,注明聚集状态与反应热书写热化学方程式.
解答 解:短周期主族元素A、B、C、D、E、F 的原子序数依次增大,B形成的化合物种类繁多,则B为C元素;C、D为空气中含量最多的两种元素,D的原子序数较大,则C为N元素,D为O元素;D、E形成两种不同的离子化合物,则E为Na;F的最高化合价为+7,所以F为Cl元素;它们的原子核外电子层数之和为13,则A原子电子层数为13-3-3-2-2-2=1,则A为H元素.
(1)A与D以 1:1的原子个数比形成的化合物为H2O2,电子式为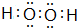 ,F为Cl元素,原子结构示意图为
,F为Cl元素,原子结构示意图为 ,
,
故答案为: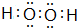 ;
; ;
;
(2)化合物甲、乙由H、C、O、Na中的三种或四种组成,且甲、乙的水溶液均呈碱性,二者可以反应,则为氢氧化钠与碳酸氢钠,故反应的离子方程式为:OH-+HCO3-=CO32-+H2O,
故答案为:OH-+HCO3-=CO32-+H2O;
(3)常温下,若将0.2mol/LMOH溶液与0.1mol/LHCl溶液等体积混合,混合后为等浓度的MOH、MCl混合溶液,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度小于MCl的水解程度,
故答案为:<;
(4)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),恰好完全反应得到MCl溶液,测得混合溶液的pH=6,说明得到的盐是强酸弱碱盐,弱碱阳离子水解,
①混合溶液中由水电离出的c(H+)=10-6mol/L,0.2mol/LHCl溶液中由水电离出的c(H+)=c(OH-)=$\frac{1{0}^{-14}}{0.2}$mol/L=5×10-14mol/L,故混合溶液中水电离出的c(H+)较大,
故答案为:>;
②根据电荷守恒:c(M+)+c(H+)=c(Cl-)+c(OH-),可得:c(Cl-)-c(M+)=c(H+)-c(OH-)=10-6 mol/L-$\frac{1{0}^{-14}}{1{0}^{-6}}$mol/L=9.9×10-7mol•L-1,
故答案为:9.9×10-7;
(5)已知500m L 0.1mol/L NaOH 溶液与足量HCl稀溶液反应,放出热量2.865KJ,则1molNaOH完全反应放出的热量为:2.865kJ×$\frac{1mol}{0.5L×0.1mol/L}$=57.3kJ,该反应的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol,
故答案为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol.
点评 本题属于拼合型题目,涉及结构性质位置关系应用、盐类水解、热化学方程式书写,需要学生具备扎实的基础,难度中等,(4)中①可以利用“生成盐促进水的电离,而HCl抑制水的电离”进行解答,不需要计算具体氢离子浓度.

 孟建平名校考卷系列答案
孟建平名校考卷系列答案| A. | 乙烯聚合为聚乙烯高分子材料 | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 以铜和浓硝酸为原料生产硝酸铜 | D. | 用二氧化硅制备高纯硅 |
| A | B | C | D | |
| 碱性 | AOH>BOH | AOH<BOH | AOH>BOH | AOH<BOH |
| 酸性 | HC>HD | HC>HD | HC<HD | HC<HD |
| A. | A | B. | B | C. | C | D. | D |
| A. | 电源是一级能源 | B. | 天然气是一级能源 | ||
| C. | 水力是二级能源 | D. | 干馏煤气是一级能源 |
| A. | 无色溶液:K+、Na+、MnO4-、SO42- | |
| B. | pH=11溶液:CO32-、Na+、K+、SO32- | |
| C. | 由水电离的 c(H+)=10-12 mol•L-1,溶液:Cl-、HCO3-、NO3-、Na+ | |
| D. | 酸性溶液:Fe2、NO3-、Cl-、NH4+ |
| A. | 向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色 | |
| B. | 向AgCl的饱和溶液中加入KCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-) | |
| C. | 常温下,AgCl在饱和KCl溶液中的Ksp比在纯水中的Ksp小 | |
| D. | 将0.001 mol•L-1的AgNO3溶液滴入NaCl和NaI的混合溶液中,一定先产生AgI沉淀 |
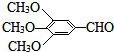 )和抗癫痫药物H(
)和抗癫痫药物H(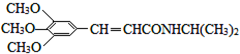 )的路线如图(部分反应略去条件和试剂):
)的路线如图(部分反应略去条件和试剂):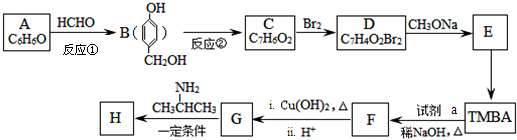
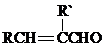 +H2O(R、R′表示烃基或氢)
+H2O(R、R′表示烃基或氢) ,试剂a的分子式是C2H4O.
,试剂a的分子式是C2H4O. +2Br2→
+2Br2→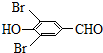 +2HBr.
+2HBr.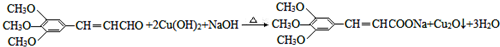 .
. )有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式
)有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式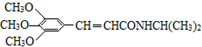 +NaOH→
+NaOH→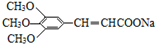 +H2NCH(CH3).
+H2NCH(CH3).
 $→_{HCl}^{Fe}$
$→_{HCl}^{Fe}$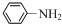
 +(CH3CO)2O→
+(CH3CO)2O→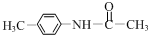 +CH3COOH.在合成F的过程中,B→C步骤不能省略,理由是氨基易被氧化,在氧化反应之前需先保护氨基.
+CH3COOH.在合成F的过程中,B→C步骤不能省略,理由是氨基易被氧化,在氧化反应之前需先保护氨基. 、
、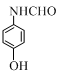 、
、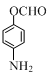 (写出3个).
(写出3个).