题目内容
6.25℃时,现有浓度均为0.10mol/L的两种溶液:①CH3COOH溶液、②NaOH溶液.(1)溶液①的pH>1(填“>”、“<”或“=”);溶液②的pH=13.
(2)两溶液等体积混合后所得溶液显碱性,原因是CH3COOH+OH-=CH3OO-+H2O、CH3OO-+H2O?CH3COOH+OH-(用离子方程式表示).
(3)下列说法正确的是bc(选填编号)
a.均属于弱电解质
b.均能抑制水的电离
c.若两溶液混合后pH<7,则溶液中离子浓度存在关系:
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
分析 (1)醋酸是弱酸,不能完全电离;
(2)在醋酸钠溶液中,醋酸钠根离子水解导致溶液显示碱性;
(3)a.弱酸、弱碱、水属于弱电解质,强酸强碱,大部分盐等属于强电解质;
b.酸和碱均能抑制水的电离;
c.若两溶液混合后pH<7,则溶液中醋酸的电离程度大于醋酸根离子的水解.
解答 解:(1)醋酸是弱酸,不能完全电离,0.10mol/L的CH3COOH溶液中氢离子浓度小于0.10mol/L,则其溶液的pH>1;
强氧化钠为强碱,0.10mol/L的溶液中氢氧根离子浓度为0.10mol/L,溶液的pH=13,
故答案为:>;,1;
(2)两溶液等体积混合后所得溶液为醋酸钠溶液,在醋酸钠溶液中,醋酸钠根离子水解导致溶液显示碱性,涉及的离子反应为:、CH3OO-+H2O?CH3COOH+OH-,
故答案为:CH3COOH+OH-=CH3OO-+H2O;CH3OO-+H2O?CH3COOH+OH-;
(3)a.醋酸属于弱电解质,氢氧化钠属于强电解质,故a错误;
b.酸和碱均能抑制水的电离,故b正确;
c.若两溶液混合后pH<7,则溶液混合后醋酸剩余,醋酸的电离程度大于醋酸根离子的水解程度,溶液中离子浓度存在关系:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故c正确;
故答案为:bc.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,涉及弱电解质的电离、盐的水解、溶液酸碱性与溶液pH的计算以及溶液中离子浓度的大小关系比较等知识,明确溶液酸碱性与溶液pH的关系及计算方法为解答关键.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
15.将镁完全溶解于一定量浓硝酸反应,得到溶液A和NO2、N2O4、NO的混合气体,这些气体与2.24L O2(标准状况)混合后通入水中正好完全被水吸收,若向所得溶液A中加入NaOH溶液至恰好完全沉淀,将所得沉淀过滤洗涤灼烧至质量不再变化,此时固体量为( )
| A. | 16g | B. | 8g | C. | 40g | D. | 0.2mol |
17.下列说法不正确的是( )
| A. | 乙烯、乙炔、溴苯分子中的所有原子均是共平面 | |
| B. | 乙烷(CH3CH3)和异丁烷( )互为同系物 )互为同系物 | |
| C. | 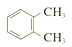 和 和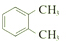 互为同分异构体 互为同分异构体 | |
| D. | 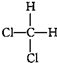 与 与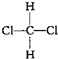 是同一种物质 是同一种物质 |
14.对于放射性同位素${\;}_{53}^{133}$I,其左下角数字“53”表示( )
| A. | 质量数 | B. | 中子数 | C. | 质子数 | D. | 电子数 |
1.某同学欲配制含下列不同阴、阳离子的混合溶液,其中能配制成功的是( )
| A. | Na+、Cu2+、Cl-、SO42- | B. | Ba2+、Na+、SO42-、Cl- | ||
| C. | NH4+、I-、K+、OH- | D. | Cu2+、Na+、S2-、SO42- |
11.下列说法正确的是( )
| A. | 蛋白质、纤维、油脂、淀粉、聚乙烯都是高分子化合物 | |
| B. | 蛋白质的水解产物为氨基酸 | |
| C. | 使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用 | |
| D. | 石油、煤、天然气、可燃冰、植物油都属于化石燃料 |
15.微粒Mn-的核外电数为x,质量数为A,则M原子核内的中子数为( )
| A. | A-x+n | B. | A-x | C. | A-x-n | D. | A-N |
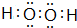 .F的原子结构示意图为:
.F的原子结构示意图为: .
.