题目内容
7.“绿色化学”是当今社会提出的一个新概念.在“绿色化学”工艺中,理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%.以下反应最符合绿色化学概念的是( )| A. | 乙烯聚合为聚乙烯高分子材料 | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 以铜和浓硝酸为原料生产硝酸铜 | D. | 用二氧化硅制备高纯硅 |
分析 A、乙烯聚合为聚乙烯高分子材料,为加聚反应;
B、甲烷与氯气制备一氯甲烷为取代反应,有副产品HCl生成;
C、以铜和浓硝酸为原料生产硝酸铜,因有有毒气体二氧化氮生成;
D、用二氧化硅制备高纯硅,有副产品CO生成.
解答 解:A、乙烯聚合为聚乙烯高分子材料,为加聚反应,原料利用率为100%,故A正确;
B、甲烷与氯气制备一氯甲烷为取代反应,有副产品HCl生成,故B错误;
C、以铜和浓硝酸为原料生产硝酸铜,因有有毒气体二氧化氮生成,故C错误;
D、用二氧化硅制备高纯硅,有副产品CO生成,故D错误;
故选A.
点评 本题主要考查“绿色化学”知识.此题难度不大,要熟悉各种反应类型,还要考虑环保、经济等方面.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
17.下列说法不正确的是( )
| A. | 乙烯、乙炔、溴苯分子中的所有原子均是共平面 | |
| B. | 乙烷(CH3CH3)和异丁烷( )互为同系物 )互为同系物 | |
| C. | 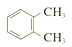 和 和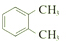 互为同分异构体 互为同分异构体 | |
| D. | 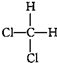 与 与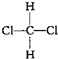 是同一种物质 是同一种物质 |
15.微粒Mn-的核外电数为x,质量数为A,则M原子核内的中子数为( )
| A. | A-x+n | B. | A-x | C. | A-x-n | D. | A-N |
12.下列有关说法不正确的是( )
| A. | 相同类型的离子晶体,晶格能越大,形成的晶体越稳定 | |
| B. | NH3和H3O+是等电子体,因此结构都是三角锥形 | |
| C. | 邻羟基苯甲醛沸点低于对羟基苯甲醛,原因是前者存在分子内氢键后者存在分子间氢键 | |
| D. | H3O+、HF2-和[Ag(NH3)2]+中均存在配位键 |

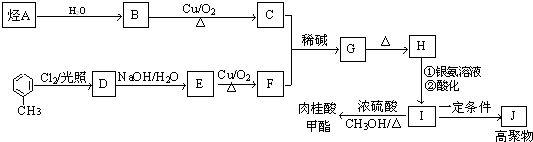
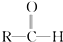 +CH3CHO$\stackrel{稀碱}{→}$
+CH3CHO$\stackrel{稀碱}{→}$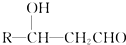 $→_{△}^{-H_{2}O}$RCH=CHCHO
$→_{△}^{-H_{2}O}$RCH=CHCHO ;J的结构简式为
;J的结构简式为 ;
; 、
、 、
、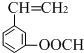 、
、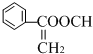 .
.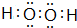 .F的原子结构示意图为:
.F的原子结构示意图为: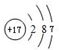 .
.