题目内容
2.一定温度下,将1mol NO2通入一个容积不变的反应容器中,达到如下平衡:2NO2?N2O4,此时NO2的转化率为x%,此时再向容器中通入2mol NO2在温度不变的条件下再达到平衡,测得NO2的转化率为y%.则x与y的关系是( )| A. | x>y | B. | x<y | C. | x=y | D. | 不能确定 |
分析 第一次达平衡后,再通入2molNO2所到达的新平衡状态,等效为在原平衡的基础上压强增大2倍所到达的平衡,增大压强平衡向体积减小的方向移动,据此分析解答.
解答 解:第一次达平衡后,再通入2molNO2所到达的新平衡状态,在恒温恒压下,等效为在原平衡的基础上压强增大2倍所到达的平衡,增大压强平衡向体积减小的方向移动,即平衡向正反应方向移动,NO2的转化率增大,故y%>x%,即x<y,
故选B.
点评 本题考查化学平衡的影响因素,难度中等,注意构建平衡建立的途径是解题的关键,注意理解压强对化学平衡的影响本质.

练习册系列答案
相关题目
12.下列说法正确的是( )
| A. | 离子键就是使阴、阳离子结合成化合物的静电引力 | |
| B. | 所有金属与所有非金属原子之间都能形成离子键 | |
| C. | 配位键在形成时,由成键双方各提供一个电子形成共用电子对 | |
| D. | 金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用 |
13.下列关于电解质溶液说法正确的是( )
| A. | NaCl溶液与CH3COOHNH4溶液均显中性,两溶液中水的电离程度相同 | |
| B. | CH3COONa溶液加水稀释:$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$减小 | |
| C. | 在NaHSO3溶液中,c(H+)+c(H2SO3)=c(OH-)+c(SO32-) | |
| D. | 含有AgCl和AgBr固体的悬浊液:c(Ag+)>c(Cl-)=c(Br-) |
7.NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,2.24L CCl4分子数目为0.1NA | |
| B. | 物质的量浓度为0.25mol/L的MgCl2溶液中,含有Cl-个数为0.5NA | |
| C. | 6.4g O2和O3的混合物中含有的氧原子数目为0.4NA | |
| D. | 用含3.01×1023个FeCl3的饱和溶液制备出的氢氧化铁胶体数目为0.5NA |
2.下图是铜锌原电池装置.下列有关该装置的说法正确的是( )
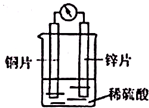

| A. | 溶液中H+向锌极移动 | |
| B. | 铜片是正极,发生氧化反应,有气泡产生 | |
| C. | 锌片上的电极反应式:Zn-2e-═Zn2+ | |
| D. | 电子由铜片经导线流向锌片 |