题目内容
7.NA表示阿伏伽德罗常数的值,下列说法正确的是( )| A. | 标准状况下,2.24L CCl4分子数目为0.1NA | |
| B. | 物质的量浓度为0.25mol/L的MgCl2溶液中,含有Cl-个数为0.5NA | |
| C. | 6.4g O2和O3的混合物中含有的氧原子数目为0.4NA | |
| D. | 用含3.01×1023个FeCl3的饱和溶液制备出的氢氧化铁胶体数目为0.5NA |
分析 A.标况下,四氯化碳为液体;
B.溶液体积未知;
C.O2和O3的都是由氧原子构成;
D.氢氧化铁胶体为氢氧化铁的聚集体判断.
解答 解:A.标况下,四氯化碳为液体,不能使用气体摩尔体积,故A错误;
B.溶液体积未知,无法计算氯离子的物质的量,故B错误;
C.O2和O3的都是由氧原子构成,6.4g O2和O3的混合物中含有的氧原子数目=$\frac{6.4g}{16g/mol}$×NA=0.4NA,故C正确;
D.由于氢氧化铁胶体为氢氧化铁的聚集体,用含3.01×1023个FeCl3的饱和溶液制备出的氢氧化铁胶体数目小于0.5NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数,题目难度不大,注意明确好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系即可解答.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
17.已知重铬酸钾(K2Cr2O7)是一种比高锰酸钾还要强的氧化剂,其溶液中存在如下平衡:2CrO42-(黄色)+2H +?Cr2O72-(橙色)+H2O若要使溶液的橙色加深,下列可采用的方法是( )
| A. | 加入适量稀盐酸 | B. | 加入适量稀硫酸 | ||
| C. | 加入适量烧碱固体 | D. | 加水稀释 |
2.一定温度下,将1mol NO2通入一个容积不变的反应容器中,达到如下平衡:2NO2?N2O4,此时NO2的转化率为x%,此时再向容器中通入2mol NO2在温度不变的条件下再达到平衡,测得NO2的转化率为y%.则x与y的关系是( )
| A. | x>y | B. | x<y | C. | x=y | D. | 不能确定 |
2.下列物质的电子式正确的是( )
| A. |  | B. | H+[O]2-H+ | C. | Na+[Cl]- | D. | Mg2+[F]$_2^-$ |
9.下列物质的水溶液因水解呈酸性的是( )
| A. | CH3COONa | B. | Na2CO3 | C. | AlCl3 | D. | KHSO4 |
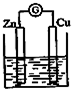 X,Y,Z,W为按原子序数由小到大排列的四种短周期的元素,X的阳离子为质子,Y原子有3个能级,各能级电子数相等,Z,W位于同一周期,Z是该周期中金属性最强的元素,W的单质是黑火药的重要成分,含有该单质的某种膏药可治疗某些皮肤病.请回答下列问题:
X,Y,Z,W为按原子序数由小到大排列的四种短周期的元素,X的阳离子为质子,Y原子有3个能级,各能级电子数相等,Z,W位于同一周期,Z是该周期中金属性最强的元素,W的单质是黑火药的重要成分,含有该单质的某种膏药可治疗某些皮肤病.请回答下列问题: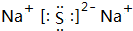 .
.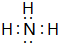 ,空间结构为三角锥形.
,空间结构为三角锥形.