题目内容
12.下列说法正确的是( )| A. | 离子键就是使阴、阳离子结合成化合物的静电引力 | |
| B. | 所有金属与所有非金属原子之间都能形成离子键 | |
| C. | 配位键在形成时,由成键双方各提供一个电子形成共用电子对 | |
| D. | 金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用 |
分析 A.离子键就是使阴、阳离子结合成化合物的静电作用;
B.非金属元素和金属元素之间可能形成共价键;
C.含有孤电子对和含有空轨道的原子之间易形成配位键;
D.金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用,饱和吸引力和排斥力.
解答 解:A.离子键就是使阴、阳离子结合成化合物的静电作用,包含吸引力和排斥力,故A错误;
B.非金属元素和金属元素之间可能形成共价键,如氯化铝中只存在共价键,故B错误;
C.含有孤电子对和含有空轨道的原子之间易形成配位键,故C错误;
D.金属晶体的构成微粒是金属阳离子和自由电子,所以金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用,饱和吸引力和排斥力,故D正确;
故选D.
点评 本题考查化学键判断,侧重考查基本概念,明确物质构成微粒及微粒之间作用力即可解答,采用举例法分析解答,注意规律中的异常现象,注意配位键的构成条件,易错选项是B.

练习册系列答案
相关题目
3.从海水中可以提取溴,但得到的液溴中常常溶有少量氯气,除去氯气应该采用的方法有( )
| A. | 加入适量的FeCl2溶液 | B. | 加入适量的KBr溶液 | ||
| C. | 加入适量的饱和食盐水 | D. | 加入适量的Na2S溶液 |
20.下列与物质分类相关的说法正确的是( )
| A. | 只含一种分子的物质一定是纯净物 | |
| B. | 由Na2O2制取O2一定要加入氧化剂 | |
| C. | 金属氧化物一定是碱性氧化物 | |
| D. | 含氧酸受热分解都能生成对应的酸酐和水 |
7.金属钠久置空气中发生变质,欲证明所得固体中既含有NaOH又含有Na2CO3,可以选择的操作步骤有:
①固体溶解
②过滤
③加入过量BaCl2溶液
④加入过量CuCl2溶液
⑤加入足量盐酸
⑥滴加无色酚酞试液.你认为最可行的方案是( )
①固体溶解
②过滤
③加入过量BaCl2溶液
④加入过量CuCl2溶液
⑤加入足量盐酸
⑥滴加无色酚酞试液.你认为最可行的方案是( )
| A. | ①③②⑤ | B. | ①④②⑤ | C. | ①③②⑥ | D. | ①⑥⑤ |
17.已知重铬酸钾(K2Cr2O7)是一种比高锰酸钾还要强的氧化剂,其溶液中存在如下平衡:2CrO42-(黄色)+2H +?Cr2O72-(橙色)+H2O若要使溶液的橙色加深,下列可采用的方法是( )
| A. | 加入适量稀盐酸 | B. | 加入适量稀硫酸 | ||
| C. | 加入适量烧碱固体 | D. | 加水稀释 |
4.下列是有关外界条件对化学反应速率和化学平衡影响的图象,其中图象和实验结论表达均正确的是( )
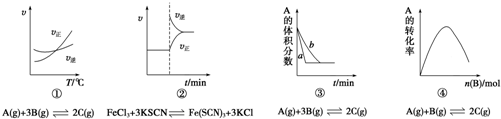

| A. | ①是其他条件一定时,反应速率随温度变化的图象,则正反应△H>0 | |
| B. | ②是在平衡体系的溶液中溶入少量KCl晶体后,化学反应速率随时间变化的图象 | |
| C. | ③是在有无催化剂存在条件下,建立平衡过程的图象,a是使用催化剂时的曲线 | |
| D. | ④是一定条件下,向含有一定量A的恒容密闭容器中逐渐加入B,达平衡时A的转化率的图象 |
