题目内容
2.下图是铜锌原电池装置.下列有关该装置的说法正确的是( )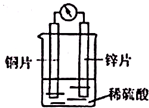
| A. | 溶液中H+向锌极移动 | |
| B. | 铜片是正极,发生氧化反应,有气泡产生 | |
| C. | 锌片上的电极反应式:Zn-2e-═Zn2+ | |
| D. | 电子由铜片经导线流向锌片 |
分析 该装置中,锌易失电子作负极,铜作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极,阳离子移向正极.
解答 解:A.该装置中,锌易失电子作负极,铜作正极,阳离子移向正极,所以H+向铜极移动,故A错误;
B.铜得电子发生还原反应而作正极,故B错误;
C.该装置为原电池,锌易失电子作负极,电极反应式:Zn-2e-═Zn2+,故C正确;
D.电子从负极锌沿导线流向正极铜,故D错误;
故选C..
点评 本题考查了原电池原理,根据电极上得失电子判断正负极,再结合电极反应类型、电子流向来分析解答,熟记原电池原理,难点是电极反应式的书写.

练习册系列答案
相关题目
2.一定温度下,将1mol NO2通入一个容积不变的反应容器中,达到如下平衡:2NO2?N2O4,此时NO2的转化率为x%,此时再向容器中通入2mol NO2在温度不变的条件下再达到平衡,测得NO2的转化率为y%.则x与y的关系是( )
| A. | x>y | B. | x<y | C. | x=y | D. | 不能确定 |
10.Co是恶性肿瘤的“克星”,它的射线能破坏癌细胞的快速繁殖,钴一60是非常广泛的放射源,在医疗上常用于肺癌和肿瘤放射治疗.下列有关${\;}_{2}^{6}$${\;}_{7}^{0}$Co的说法中正确的是( )
| A. | 质子数为60 | B. | 原子序数为27 | C. | 中子数为27 | D. | 核外电子数为33 |
17.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 28g乙烯的气体中含有H原子数为2NA | |
| B. | 标准状况下,2.24L乙醇与足量Na反应生成H2分子数0.05NA | |
| C. | 每摩尔-OH中含电子数目为9NA | |
| D. | 每摩尔苯中含有的碳碳双键的数目为3NA |
14.关于下列图示的说法中正确的是( )
| A. |  用如图所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. |  用如图所示实验装置通过排空气法收集C2H4气体 | |
| C. |  如图所示装置可用于制取乙酸乙酯,分液漏斗中装的是乙醇 | |
| D. | 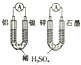 如图两个装置中提供导线的电子数相同时,生成H2的物质的量也相同 |
11.下列说法正确的是( )
| A. | 淀粉和纤维素在人体内均可水解生成葡萄糖 | |
| B. | 溴乙烷在浓硫酸、加热的条件下发生消去反应生成乙烯 | |
| C. | 乙烯、苯分子中都含有碳碳双键,都能发生加成反应 | |
| D. | 饱和Na2SO4溶液和浓硝酸均可使蛋白质溶液产生沉淀,但原理不同 |