题目内容
4.为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)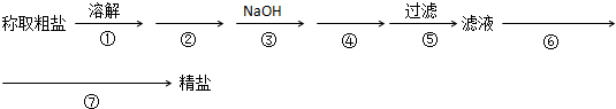
(1)②④⑥三步所加试剂分别是Na2CO3、BaCl2、适量盐酸
(2)第④步发生反应的离子方程式为Ba2++CO32-=BaCO3↓、Ca2++CO32-=CaCO3↓
(3)第⑦步的操作名称蒸发结晶 需要的玻璃仪器有酒精灯、玻璃棒.
分析 (1)除去钙离子用碳酸钠、除去镁离子用氢氧化钠、除去硫酸根离子用氯化钡,过滤后用盐酸除去过量的氢氧根离子、碳酸根离子,碳酸钠必须放在氯化钡溶液之后,据此判断;
(2)加入碳酸钠的目的是将溶液中的杂质离子钙离子以及多余的钡离子除去;
(3)从溶液获得精盐晶体,需要通过蒸发结晶操作完成,根据操作方法判断使用的玻璃仪器.
解答 解:(1)除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,用碳酸钠除去钙离子、用氯化钡除去硫酸根离子、用氢氧化钠除去镁离子,由于加入的氯化钡试剂是过量的,则为了除去过量的钡离子,则碳酸钠应该放在氯化钡溶液之后,将沉淀过滤后用盐酸中和,则②④⑥分别为Na2CO3、BaCl2、适量盐酸,
故答案为:Na2CO3;BaCl2;适量盐酸;
(2)加入试剂碳酸钠来将溶液中的杂质离子钙离子以及多余的钡离子除去,反应方程式为:Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓,
故答案为:Ba2++CO32-=BaCO3↓、Ca2++CO32-=CaCO3↓;
(3)第⑦步是将获得的滤液蒸发、结晶获得精盐,蒸发操作用到的玻璃仪器为:玻璃棒和酒精灯,
故答案为:蒸发结晶;酒精灯、玻璃棒.
点评 本题考查了粗盐的提纯,题目难度不大,明确除杂的方法和原则为解答关键,注意除去多种杂质时,要考虑加入试剂的顺序,为了保证将杂质除尽,所加试剂必须过量,因此为了不引进新的杂质,后面加入的试剂要能够除去前面所进入的过量试剂.

练习册系列答案
相关题目
4.下列是有关外界条件对化学反应速率和化学平衡影响的图象,其中图象和实验结论表达均正确的是( )


| A. | ①是其他条件一定时,反应速率随温度变化的图象,则正反应△H>0 | |
| B. | ②是在平衡体系的溶液中溶入少量KCl晶体后,化学反应速率随时间变化的图象 | |
| C. | ③是在有无催化剂存在条件下,建立平衡过程的图象,a是使用催化剂时的曲线 | |
| D. | ④是一定条件下,向含有一定量A的恒容密闭容器中逐渐加入B,达平衡时A的转化率的图象 |
5.下列有关能源的说法不正确的是( )
| A. | 人类利用能源的三个阶段分别是:柴草时期、化石能源时期、多能源结构时期 | |
| B. | 人类使用沼气是对化学能的充分利用 | |
| C. | 海底有大量的天然气水合物-“可燃冰”,它是一种比较洁净的能源 | |
| D. | 生物质能主要指用树木、庄稼、草类等植物直接或间接提供的能量,它是不可再生的能源 |
2.一定温度下,将1mol NO2通入一个容积不变的反应容器中,达到如下平衡:2NO2?N2O4,此时NO2的转化率为x%,此时再向容器中通入2mol NO2在温度不变的条件下再达到平衡,测得NO2的转化率为y%.则x与y的关系是( )
| A. | x>y | B. | x<y | C. | x=y | D. | 不能确定 |
9.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 用石墨作电极电解饱和食盐水时,若阴极得到2NA个电子,则阳极产生22.4L气体 | |
| B. | 常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移的电子数目是0.8NA | |
| C. | 1L 1mol/L的K2CO3溶液中离子总数小于3NA | |
| D. | 室温下,42.0g 乙烯和丙烯的混合气体中含有的碳原子数为3NA |
9.下列物质的水溶液因水解呈酸性的是( )
| A. | CH3COONa | B. | Na2CO3 | C. | AlCl3 | D. | KHSO4 |
16.用下列实验装置能达到所述的实验目的是( )
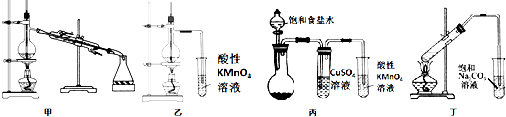

| A. | 利用装置甲既可以进行石油的分馏,也可以进行酒精的浓缩 | |
| B. | 利用装置乙可以完成实验室制备乙烯气体并检验乙烯气体的生成 | |
| C. | 利用装置丙可以完成实验室制备乙炔气体并检验乙炔气体的生成 | |
| D. | 利用装置丁可以完成实验室制备乙酸乙酯并收集较为纯净的乙酸乙酯 |
14.关于下列图示的说法中正确的是( )
| A. |  用如图所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 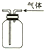 用如图所示实验装置通过排空气法收集C2H4气体 | |
| C. |  如图所示装置可用于制取乙酸乙酯,分液漏斗中装的是乙醇 | |
| D. | 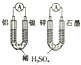 如图两个装置中提供导线的电子数相同时,生成H2的物质的量也相同 |