题目内容
氧元素与多种元素具有亲和力,所形成化合物的种类仅次于碳元素。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为 ,氧元素与氟元素能形成OF2分子,该分子的空间构型为 。
(2)根据等电子原理,判断NO2+离子中,氮原子轨道的杂化类型为 ,1molO22+所含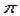 键的数目为 。
键的数目为 。
(3)氧元素与过渡元素可以形成多种价态的金属氧化物。如铬可生成Cr2O3、CrO3等,试写出Cr3+核外电子排式 。
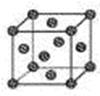
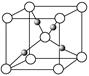
(4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:
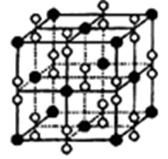
由此可判断该钙的氧化物的化学式为 。已知晶胞边长为540pm,则该氧化物的密度是 g·cm-3。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为 ,氧元素与氟元素能形成OF2分子,该分子的空间构型为 。
(2)根据等电子原理,判断NO2+离子中,氮原子轨道的杂化类型为 ,1molO22+所含
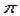 键的数目为 。
键的数目为 。(3)氧元素与过渡元素可以形成多种价态的金属氧化物。如铬可生成Cr2O3、CrO3等,试写出Cr3+核外电子排式 。
(4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:

由此可判断该钙的氧化物的化学式为 。已知晶胞边长为540pm,则该氧化物的密度是 g·cm-3。
(1)F N O V
(2)sp 2NA
(3)[Ar]3d3或1s22s22p63s23p63d3
(4)CaO2;3.04g/cm3
(2)sp 2NA
(3)[Ar]3d3或1s22s22p63s23p63d3
(4)CaO2;3.04g/cm3
(1)第一电离能由大到小顺序是FNO,由于O中的孤电子对对数=(6-2×1)/2=2,所以OF2分子的空间构型是V形。
(2)NO2+与CO2是等电子体,所以N是sp杂化;O22+离子与N2互为等电子体,1molN2中含有2mol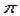 ,故1molO22+所含
,故1molO22+所含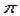 键的数目2NA。
键的数目2NA。
(3)Cr是24号元素,所以Cr3+的核外电子排布式是[Ar]3d3或1s22s22p63s23p6d3
(4)该晶胞结构与NaCl结构相似,所以它的化学式为CaO2,密度=4×72/(NA ×5403×10-30)= 3.04g/cm3。
(2)NO2+与CO2是等电子体,所以N是sp杂化;O22+离子与N2互为等电子体,1molN2中含有2mol
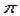 ,故1molO22+所含
,故1molO22+所含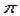 键的数目2NA。
键的数目2NA。(3)Cr是24号元素,所以Cr3+的核外电子排布式是[Ar]3d3或1s22s22p63s23p6d3
(4)该晶胞结构与NaCl结构相似,所以它的化学式为CaO2,密度=4×72/(NA ×5403×10-30)= 3.04g/cm3。

练习册系列答案
相关题目
 4FeCl2+N2O↑+6HCl+H2O
4FeCl2+N2O↑+6HCl+H2O