题目内容
一定条件下, Ni2+与丁二酮肟生成鲜红色沉淀A。

(1)基态Ni原子的价层电子排布式为 。
(2)丁二酮肟组成元素中C、N、O的第一电离能由小到大的顺序为 。
丁二酮肟分子中C原子轨道的杂化类型是 。
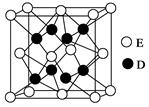
(3)元素Ni的一种碲(Te)化物晶体的晶胞结构如图所示,则该化合物的化学式为 。
(4)Ni(CO)4是一种无色液体,沸点为42.1℃,熔点为-19.3℃。Ni(CO)4的晶体类型是 。请写出一种由第二周期主族元素组成的且与CO互为等电子体的阴离子的电子式 。

(1)基态Ni原子的价层电子排布式为 。
(2)丁二酮肟组成元素中C、N、O的第一电离能由小到大的顺序为 。
丁二酮肟分子中C原子轨道的杂化类型是 。
(3)元素Ni的一种碲(Te)化物晶体的晶胞结构如图所示,则该化合物的化学式为 。
(4)Ni(CO)4是一种无色液体,沸点为42.1℃,熔点为-19.3℃。Ni(CO)4的晶体类型是 。请写出一种由第二周期主族元素组成的且与CO互为等电子体的阴离子的电子式 。
(1)3d84s2 (2分) (2)C<O<N (2分) sp3和sp2(2分)(3)NiTe2(2分)
(4)分子晶体 (2分)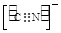 或
或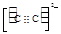 (2分,其它合理也得分)
(2分,其它合理也得分)
(4)分子晶体 (2分)
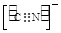 或
或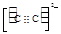 (2分,其它合理也得分)
(2分,其它合理也得分)试题分析:(1)Ni为28号元素,所以基态Ni原子的价层电子排布式为:3d84s2
(2)N原子2p轨道电子数为3,正好为半充满状态,处于稳定状态,失电子较难,所以C、N、O的第一电离能由小到大的顺序为:C<O<N;丁二酮肟中-CH3中C原子为sp2杂化,C=N中C原子形成两个碳碳单键和一个碳氮双键,为sp3杂化,所以丁二酮肟分子中C原子轨道的杂化类型是sp3和sp2
(3)根据均摊法,Ni位于晶胞的顶点,含Ni数目为:8×1/8=1,Te位于晶胞内部,数目为2,所以该化合物的化学式为NiTe2
(4)Ni(CO)4是一种无色液体,沸点为42.1℃,熔点为-19.3℃,熔沸点低,所以为分子晶体;原子数目和价电子数相等的微粒互为等电子体,所以与CO互为等电子体的阴离子为CN-或C22-,电子式分别为:
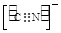 或
或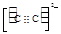 。
。
练习册系列答案
相关题目
 键的数目为 。
键的数目为 。
 、NA的计算式表示)
、NA的计算式表示)