题目内容
(15分)
已知:(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下:

4FeCl3+2NH2OH·HCl 4FeCl2+N2O↑+6HCl+H2O
4FeCl2+N2O↑+6HCl+H2O
①Fe2+在基态时,价层电子排布式 。 ②羟胺(NH2OH)中N原子的杂化方式 。
③Fe2+与邻啡罗啉形成的配合物中,配位数为 。
(2)硫酸铜晶体的化学式也可以表达为Cu(H2O)4SO4·H2O晶体,该晶体中含有的化学键类型是
(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、磷化镓及铜锢硒薄膜电池等。 其中元素P、As、Se第一电离能由小到大的顺序为: 。


图1 图2
(4)① 有机太阳能固体电池材料含有高纯度C60,其结构如图1,则1 mol C60分子中π键的数目为 ,C60的晶胞结构如图2,则其配位数为_______若此晶胞的密度为ρg/cm3则两个最近C60间的距离为________cm(列式表达,已知阿伏伽德罗常数为NA)
② 如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,第四周期电负性最小的原子可作为容体掺入C60晶体的空隙中,形成具有良好的超导性的掺杂C60化合物。若每个四面体空隙填入一个原子,则全部填满C60晶体的四面体空隙后,所形成的掺杂C60化合物的化学式为 。
已知:(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下:

4FeCl3+2NH2OH·HCl
 4FeCl2+N2O↑+6HCl+H2O
4FeCl2+N2O↑+6HCl+H2O①Fe2+在基态时,价层电子排布式 。 ②羟胺(NH2OH)中N原子的杂化方式 。
③Fe2+与邻啡罗啉形成的配合物中,配位数为 。
(2)硫酸铜晶体的化学式也可以表达为Cu(H2O)4SO4·H2O晶体,该晶体中含有的化学键类型是
(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、磷化镓及铜锢硒薄膜电池等。 其中元素P、As、Se第一电离能由小到大的顺序为: 。


图1 图2
(4)① 有机太阳能固体电池材料含有高纯度C60,其结构如图1,则1 mol C60分子中π键的数目为 ,C60的晶胞结构如图2,则其配位数为_______若此晶胞的密度为ρg/cm3则两个最近C60间的距离为________cm(列式表达,已知阿伏伽德罗常数为NA)
② 如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,第四周期电负性最小的原子可作为容体掺入C60晶体的空隙中,形成具有良好的超导性的掺杂C60化合物。若每个四面体空隙填入一个原子,则全部填满C60晶体的四面体空隙后,所形成的掺杂C60化合物的化学式为 。
(1)①3d6;② sp3;③ 6;(2)离子键 共价键(配位键)
(3)Se< As< P (4)① 30NA;12 ;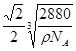 ② K 2C60
② K 2C60
(3)Se< As< P (4)① 30NA;12 ;
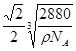 ② K 2C60
② K 2C60 试题分析:(1)①Fe是26号元素,在Fe2+的核外有24个电子,在基态时,价层电子排布式3d6;②羟胺(NH2OH)中N原子的杂化方式sp3杂化; ③由化合物的结构简式可知:Fe2+与邻啡罗啉形成的配合物中,配位数为6;(2)在硫酸铜晶体Cu(H2O)4SO4·H2O中含有的化学键为离子键、共价键、配位键;(3)元素P、As是同一主族的元素,从上到下,原子半径增大,原子失去电子容易,所以第一电离能P>As;As、Se是同一周期的元素,原子半径As>Se,但是由于As原子的最外层的价电子处于该轨道的半充满的稳定状态,所以第一电离能As>Se.因此这三种元素的第一电离能由小到大的顺序为Se< As< P;(4)①在一个C60分子中含有60个C原子,每个C原子与连接的C原子形成了一个π键,而π键是两个原子所共有的,因此平均每个C原子含有的π键个数为1/2π键,。所以1 mol C60分子中π键的数目为60πNA÷2=30NA。由C60的晶胞结构示意图可知,它是立方面心结构,与每个C原子紧密连接的距离最近的C原子个数为(3÷8)÷2=12.即其配位数为12。每个晶胞中含有的C60分子个数是8×1/8+6×1/2=4;所以晶胞的边长
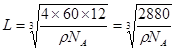 。根据晶胞示意图图可知两个最近C60间的距离为面对角线的一半,就是
。根据晶胞示意图图可知两个最近C60间的距离为面对角线的一半,就是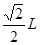 即为
即为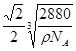 。②第四周期电负性最小的原子是K原子,由于每个顶点可形成1/4个四面体,一共有8个顶点,所以可形成2个正四面体。故可填充2个K原子,所形成的掺杂C60化合物的化学式为K 2C60。60化合物的化学式的确定的知识。
。②第四周期电负性最小的原子是K原子,由于每个顶点可形成1/4个四面体,一共有8个顶点,所以可形成2个正四面体。故可填充2个K原子,所形成的掺杂C60化合物的化学式为K 2C60。60化合物的化学式的确定的知识。
练习册系列答案
相关题目

 ,则分子中 σ 键与 π 键之比为
,则分子中 σ 键与 π 键之比为 



 键的数目为 。
键的数目为 。