题目内容
18.含氮的物质丰富多彩(1)从分子结构上看,氮与碳有很多对应的物质(如甲烷跟氨气对应),请找出下列含碳化合物对应的含氮物质:C2H4N2H2C2H2N2.
(2)化学式为N4的分子结构等同于白磷,N4中每个原子满足最外层8e-结构.则1个N4中含有6NA对共用电子对.
(3)某化合物的焰色反应为黄色,根据质谱分析它的相对分子质量为39且与水反应能生成氨气.则该化合物中存在的化学键类型为离子键、共价键,其与过量盐酸反应的化学方程式为NaNH2+2HCl=NaCl+NH4Cl.
(4)某化合物A是一种易溶于水的不含结晶水的盐,溶于水后可完全电离出三种中学化学常见离子,其中有两种是10电子的阳离子.用A进行如下实验:取2.370gA溶于蒸馏水配成溶液;向该溶液中逐滴加入一定量的氢氧化钠溶液,过程中先观察到产生白色沉淀B,后产生能使湿润红色石蕊试纸变蓝的气体C,气体不再产生时沉淀开始溶解,当沉淀恰好完全溶解时共用去氢氧化钠的物质的量为0.050mol.回答下列问题:
①化合物A的化学式为NH4Al(SO4)2;请设计实验方案验证A中阴离子取少量A的溶液于试管中,加入足量的稀盐酸酸化,再加入氯化钡,若有白色沉淀生成,说明A中的阴离子为硫酸根离子;
②请写出足量气体C与氯气发生氧化还原反应的化学方程式3Cl2+8NH3=N2+6NH4Cl.
分析 (1)甲烷跟氨气对应,故CH2=与NH=对应,CH≡与N≡对应,据此分析;
(2)白磷分子为正四面体,每个边都代表一个P-P键,所以共6个P-P共价键,据此推断即可;
(3)化合物的焰色反应为黄色,故含钠元素;相对分子质量为39且与水反应能生成氨气,故除了含有钠元素,还还有N元素,故此化合物为NaNH2,据此分析化合键的类型和与盐酸的反应;
(4)由信息可知,A与NaOH溶液反应,先观察到产生白色沉淀B,后产生能使湿润红色石蕊试纸变蓝的气体C,气体不再产生时沉淀开始溶解,则气体C为氨气,白色沉淀为氢氧化铝,A中含NH4+、Al3+,均为10电子的阳离子,沉淀恰好完全溶解时共用去氢氧化钠的物质的量为0.050mol,由Al3++3OH-=Al(OH)3↓、NH4++OH-=NH3.H2O、Al(OH)3+OH-=AlO2-+2H2O可知,NH4+、Al3+为1:1,则A中含阴离子带2个单位的负电荷,且与铵根离子、铝离子不反应,则阴离子可为SO42-,以此来解答.
解答 解:(1)甲烷跟氨气对应,故CH2=与NH=对应,CH≡与N≡对应,则乙烯CH2=CH2所对应的含氮物质为:NH=NH,即N2H2;乙炔CH≡CH所对应的含氮物质为N2,故答案为:N2H2,N2;
(2)白磷分子为正四面体,每个边都代表一个P-P键,所以共6个P-P共价键,N4的结构等同于白磷,故1molN4中含有6molN-N键,即6NA个共用电子对,故答案为:6;
(3)化合物的焰色反应为黄色,故含钠元素;相对分子质量为39且与水反应能生成氨气,故除了含有钠元素,还还有N元素,故此化合物为NaNH2,由离子键和共价键构成,和与盐酸的反应:NaNH2+2HCl=NaCl+NH4Cl,故答案为:离子键、共价键,NaNH2+2HCl=NaCl+NH4Cl;
(4)由信息可知,A与NaOH溶液反应,先观察到产生白色沉淀B,后产生能使湿润红色石蕊试纸变蓝的气体C,气体不再产生时沉淀开始溶解,则气体C为氨气,白色沉淀为氢氧化铝,A中含NH4+、Al3+,均为10电子的阳离子,沉淀恰好完全溶解时共用去氢氧化钠的物质的量为0.050mol,由Al3++3OH-=Al(OH)3↓、NH4++OH-=NH3.H2O、Al(OH)3+OH-=AlO2-+2H2O可知,NH4+、Al3+为1:1,则A中含阴离子带2个单位的负电荷,且与铵根离子、铝离子不反应,则阴离子可为SO42-,
①由上述分析可知A为NH4Al(SO4)2,检验A中阴离子的方法为取少量A的溶液于试管中,加入足量的稀盐酸酸化,再加入氯化钡,若有白色沉淀生成,说明A中的阴离子为硫酸根离子,故答案为:NH4Al(SO4)2;取少量A的溶液于试管中,加入足量的稀盐酸酸化,再加入氯化钡,若有白色沉淀生成,说明A中的阴离子为硫酸根离子;
②C与氯气发生氧化还原反应的化学方程式为3Cl2+8NH3=N2+6NH4Cl,故答案为:3Cl2+8NH3=N2+6NH4Cl.
点评 本题考查无机物的推断,为高频考点,把握铵根离子、铝离子的检验为解答的关键,注意阴离子可由电荷守恒分析,侧重分析与推断能力的综合考查,题目难度中等.

 春雨教育同步作文系列答案
春雨教育同步作文系列答案| A. | pH<7的溶液中:S${{O}_{4}}^{2-}$、C${{O}_{3}}^{2-}$、Na+、K+ | |
| B. | 使酚酞变红色的溶液中:Na+、K+、Cl-、CH3COO- | |
| C. | 0.1 mol•L-1 NH4Al(SO4)2溶液中:Al${{O}_{2}}^{-}$、Mg2+、Cl-、S${{O}_{4}}^{2-}$ | |
| D. | $\frac{{c(H}^{+})}{{c(OH}^{-})}$=1012的溶液中:Na+、Ba2+、N${{O}_{3}}^{-}$、ClO- |
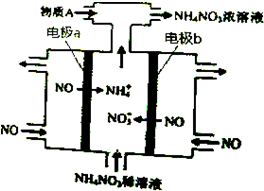
| A. | b极的电极反应为:NO-3e-+2H2O=NO3-+4H+ | |
| B. | 溶液中的H+由电极a处向电极b处迁移 | |
| C. | 电解过程总反应的化学方程式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3 | |
| D. | 为使电解产物全部转化为NH4NO3,需补充的物质A是NH3 |
| A. | 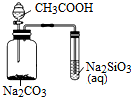 不能用来检验CH3COOH、H2CO3、H2SiO3酸性的强弱 | |
| B. | 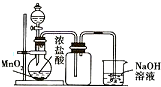 可用来制取并收集氯气 | |
| C. | 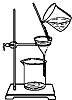 可用来分离氢氧化铁胶体中的胶体粒子 | |
| D. | 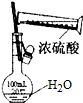 可用来配制一定物质的量浓度的稀硫酸 |
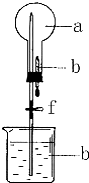 如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与试验事实不相符的是( )
如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与试验事实不相符的是( )| A. | CO2(NaHCO3溶液)无色喷泉 | B. | NH3(H2O含酚酞)红色喷泉 | ||
| C. | Cl2(NaOH溶液)无色喷泉 | D. | HCl(AgNO3溶液)白色喷泉 |
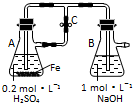
| A. | 用如图装置可以制备沉淀Fe(OH)2 | |
| B. | 配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度 | |
| C. | FeCl3溶液中滴加KSCN溶液会生成红色沉淀 | |
| D. | 向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化 |
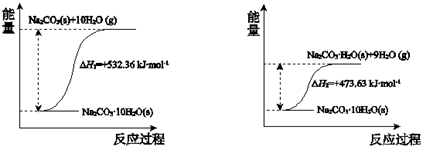


 .
.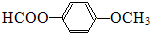 、
、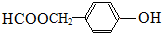 或
或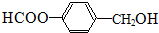 (任写一种).
(任写一种).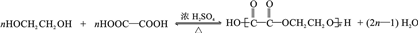 .
.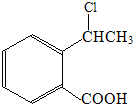 为原料制
为原料制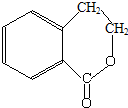 的合成路线流程图(无机试剂任用),在方框中填出相应的物质,并在括号注明反应条件.合成路线流程图示例如图2:
的合成路线流程图(无机试剂任用),在方框中填出相应的物质,并在括号注明反应条件.合成路线流程图示例如图2: