题目内容
【题目】二甲醚(CH3OCH3)是一种新型能源。
已知:①CO(g)+2H2(g)![]() CH3OH(g) △H1=﹣99kJ·mol-1
CH3OH(g) △H1=﹣99kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=﹣24kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=﹣24kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=﹣41kJ·mol-1
CO2(g)+H2(g) △H3=﹣41kJ·mol-1
回答下列问题:
(1)写出CO和H2反应生成CO2和CH3OCH3(g)的热化学方程式_____。
(2)下列既能提高反应①中 CO 的平衡转化率,又能增大反应速率的是____(填标号)。
a.增大压强 b.降低温度 c.增大H2浓度 d.加高效催化剂
(3)在某恒温恒容容器中发生反应③,能说明该反应达到平衡的是___(填标号)。
a.气体平均相对分子质量保持不变
b.△H3保持不变
c.![]() 保持不变
保持不变
d.气体密度保持不变
(4)在一定温度(T℃)下,向恒容密闭容器中通入一定量CH3OH气体,只发生反应②。气体混合物中CH3OCH3 的物质的量分数[φ(CH3OCH3)]与反应时间(t)有关数据如表所示。
t/min | 0 | 15 | 30 | 45 | 80 | 100 |
φ(CH3OCH3) | 0 | 0.05 | 0.08 | 0.09 | 0.10 | 0.10 |
①该温度下,上述反应的平衡常数K为___(用分数表示)。
②反应速率v=v正﹣v逆,其中v正=k正·φ2(CH3OH)、v逆=k逆·φ(CH3OCH3)·φ(H2O),k正、k 逆分别为正、逆反应速率常数,![]() 只与温度有关。15min时,=___(结果保留2位小数)。
只与温度有关。15min时,=___(结果保留2位小数)。
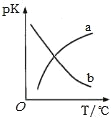
(5)在密闭容器中发生反应③,平衡常数为K。pK(pK=﹣lgK)与温度的关系如图所示,图中曲线___(填“a”或“b”)能反映平衡常数变化趋势。
【答案】3CO(g)+3H2(g)CH3OCH3(g)+CO2(g)△H=-263KJmol-1 a、c c ![]() 5.06 a
5.06 a
【解析】
(1)已知①CO( g)+2H2(g)CH3OH( g)△H1=-99kJmol-1,
②2CH3OH(g)CH3OCH3(g)+H2O(g)△H2=-24kJmol-1,
③CO(g)+H2O(g)CO2(g)+H2(g)△H3=-41kJmol-1,
根据盖斯定律,①×2+②+③得3CO(g)+3H2(g)CH3OCH3(g)+CO2(g)△H=-263kJmol-1,故答案为:3CO(g)+3H2(g)CH3OCH3(g)+CO2(g)△H=-263KJmol-1。
(2)要使反应①中 CO 的平衡转化率提高,也就是平衡向右移动;又能增大反应速率,也就是外界影响的因素是增大或升高。降温可以使CO 的平衡转化率提高,但反应速率减慢,b错误;加高效催化剂反应速率加快,但平衡不移动,d错误;因此方法有增大压强、增大H2浓度; 答案选a、c。
(3)当反应体系中某个变量在一定条件下保持不变的状态,可判定反应达到平衡状态。反应③CO(g)+H2O(g)CO2(g)+H2(g)△H3=-41kJmol-1为反应前后气体体积不变的纯气体体系,恒温恒容下,根据质量守恒,反应前后气体总质量不变,当气体平均相对分子质量保持不变时,气体的物质的量也不变,不能判定平衡状态,a错误;反应热不能作为判定平衡依据,△H3保持不变不能判定达到平衡状态,b错误;![]() 保持不变,不能判定平衡状态,c正确;反应前后气体体积相等,恒容条线下,反应前后气体总质量不变气体密度始终保持不变,不能判定平衡状态,d错误;答案选c。
保持不变,不能判定平衡状态,c正确;反应前后气体体积相等,恒容条线下,反应前后气体总质量不变气体密度始终保持不变,不能判定平衡状态,d错误;答案选c。
(4)①根据表格显示,80min时反应②达到平衡,设CH3OH初始量为1 mol/L,达到平衡时CH3OCH3为x mol/L,根据反应
2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H2=﹣24kJ·mol-1
CH3OCH3(g)+H2O(g)△H2=﹣24kJ·mol-1
初始: 1 0 0
变化: x x x
平衡:(1-x) x x
φ(CH3OCH3)= ![]() =0.1 x=
=0.1 x=![]()
平衡常数为:![]() =
=![]()
②15min时,CH3OCH3和H2O的的物质的量分数均为0.05,CH3OH的物质的量分数为0.9,故![]()
![]()
![]()
(5)升高温度,平衡逆向(吸热方向)进行,平衡常数K减小,pK越大。曲线a正确。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】下表为元素周期表的一部分,根据表中所列出的元素回答下列问题。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
2 | a | b | c | d | |||
3 | e | f | g | h | i | j |
(1)f和d形成的物质的化学式为____。
(2)ac2分子的电子式为___。
(3)g单质溶于NaOH溶液的离子方程式为____。
(4)e单质在氧气中点燃得到淡黄色固体
①淡黄色固体的电子式为___,
②该物质存在的化学键的类型有___。
(5)为了比较该部分周素表中非金属元素的非金属性强弱,以下说法不正确的是___。
a.可以利用这些元素的最高价氧化物对应水化物的酸性比较这些元素的非金属性
b.已知j的气态氢化物水溶液的酸性比i的气态氢化物的水溶液酸性强,则非金属j>i
c.向i的气态氢化物的水溶液中加j单质,发现溶液变浑浊,则i的非金属性弱于j
【题目】根据下列实验现象所得出的结论不正确的是
选项 | 实验现象 | 实验结论 |
A | 将铝片分别投入浓、稀硝酸中, 前者无明显现象,后者反应剧烈 | 稀硝酸的氧化性比浓硝酸的强 |
B | 向滴有酚酞的Na2CO3溶液中 加入BaCl2溶液,红色变浅 | Na2CO3溶液中存在水解平衡 |
C | 某溶液中滴加过量氨水产生 白色沉淀且不溶解 | 该溶液中可能含有Mg2+ |
D | 溴水中通入SO2,溴水褪色 | SO2具有还原性 |
A. AB. BC. CD. D