题目内容
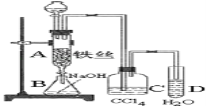
【题目】某化学课外小组用如图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
(1)写出A中反应的化学方程式___。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是___,写出有关反应的离子方程式____。
(3)C中盛放CCl4的作用是____。
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入___,现象是____。
【答案】C6H6+Br2![]() C6H5Br+HBr 除去溶于溴苯中的溴 Br2+2OH-=Br-+BrO-+H2O 除去溴化氢气体中的溴蒸气 石蕊试液 溶液变红色
C6H5Br+HBr 除去溶于溴苯中的溴 Br2+2OH-=Br-+BrO-+H2O 除去溴化氢气体中的溴蒸气 石蕊试液 溶液变红色
【解析】
苯和液溴在铁作催化剂作用下反应生成溴苯和溴化氢,生成的溴苯中混合溴单质,将反应后的液体放入到氢氧化钠溶液中除掉溴单质,制溴苯反应是放热反应,生成HBr同时由于溴易挥发,因此HBr和溴蒸汽进入到后面装置中,将有机溶剂萃取溴单质,HBr溶于水电离出氢离子和溴离子,用紫色石蕊或硝酸银来验证。
⑴A中是苯和液溴在铁作催化剂作用下反应生成溴苯和溴化氢,其反应的化学方程式C6H6 + Br2![]() C6H5Br+HBr;故答案为:C6H6+Br2
C6H5Br+HBr;故答案为:C6H6+Br2![]() C6H5Br+HBr。
C6H5Br+HBr。
⑵实验结束时,打开A下端的活塞,反应液中含有未反应完的溴单质,让反应液流入B中,充分振荡,目的是除去溶于溴苯中的溴,氢氧化钠和溴单质反应生成溴化钠、次溴酸钠和水,其反应的离子方程式Br2+2OH- = Br-+BrO-+H2O;故答案为:除去溶于溴苯中的溴;Br2+2OH- = Br-+BrO-+H2O。
⑶为了验证发生取代反应,因此生成溴化氢同时还有溴蒸汽进入到后面装置中,因此C中盛放CCl4的作用是除去溴化氢气体中的溴蒸气;故答案为:除去溴化氢气体中的溴蒸气。
⑷能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法利用HBr溶于水溶液显酸性,用紫色石蕊来验证,因此是向试管D中加入石蕊试液,现象是溶液变红色;故答案为:石蕊试液;溶液变红色。

 寒假学与练系列答案
寒假学与练系列答案【题目】二甲醚(CH3OCH3)是一种新型能源。
已知:①CO(g)+2H2(g)![]() CH3OH(g) △H1=﹣99kJ·mol-1
CH3OH(g) △H1=﹣99kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=﹣24kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=﹣24kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=﹣41kJ·mol-1
CO2(g)+H2(g) △H3=﹣41kJ·mol-1
回答下列问题:
(1)写出CO和H2反应生成CO2和CH3OCH3(g)的热化学方程式_____。
(2)下列既能提高反应①中 CO 的平衡转化率,又能增大反应速率的是____(填标号)。
a.增大压强 b.降低温度 c.增大H2浓度 d.加高效催化剂
(3)在某恒温恒容容器中发生反应③,能说明该反应达到平衡的是___(填标号)。
a.气体平均相对分子质量保持不变
b.△H3保持不变
c.![]() 保持不变
保持不变
d.气体密度保持不变
(4)在一定温度(T℃)下,向恒容密闭容器中通入一定量CH3OH气体,只发生反应②。气体混合物中CH3OCH3 的物质的量分数[φ(CH3OCH3)]与反应时间(t)有关数据如表所示。
t/min | 0 | 15 | 30 | 45 | 80 | 100 |
φ(CH3OCH3) | 0 | 0.05 | 0.08 | 0.09 | 0.10 | 0.10 |
①该温度下,上述反应的平衡常数K为___(用分数表示)。
②反应速率v=v正﹣v逆,其中v正=k正·φ2(CH3OH)、v逆=k逆·φ(CH3OCH3)·φ(H2O),k正、k 逆分别为正、逆反应速率常数,![]() 只与温度有关。15min时,=___(结果保留2位小数)。
只与温度有关。15min时,=___(结果保留2位小数)。
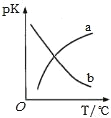
(5)在密闭容器中发生反应③,平衡常数为K。pK(pK=﹣lgK)与温度的关系如图所示,图中曲线___(填“a”或“b”)能反映平衡常数变化趋势。