��Ŀ����
����Ŀ���±�ΪԪ�����ڱ���һ���֣����ݱ������г���Ԫ�ػش��������⡣
�� ���� | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
2 | a | b | c | d | |||
3 | e | f | g | h | i | j |
��1��f��d�γɵ����ʵĻ�ѧʽΪ____��
��2��ac2���ӵĵ���ʽΪ___��
��3��g��������NaOH��Һ�����ӷ���ʽΪ____��
��4��e�����������е�ȼ�õ�����ɫ����
�ٵ���ɫ����ĵ���ʽΪ___��
�ڸ����ʴ��ڵĻ�ѧ����������___��
��5��Ϊ�˱Ƚϸò������ر��зǽ���Ԫ�صķǽ�����ǿ��������˵������ȷ����___��
a.����������ЩԪ�ص�����������Ӧˮ��������ԱȽ���ЩԪ�صķǽ�����
b.��֪j����̬�⻯��ˮ��Һ�����Ա�i����̬�⻯���ˮ��Һ����ǿ����ǽ���j��i
c.��i����̬�⻯���ˮ��Һ�м�j���ʣ�������Һ����ǣ���i�ķǽ���������j
���𰸡�MgF2 ![]() 2Al+2H2O+2OH-=2AlO2-+3H2��
2Al+2H2O+2OH-=2AlO2-+3H2�� ![]() ���Ӽ��ͷǼ��Թ��ۼ� b
���Ӽ��ͷǼ��Թ��ۼ� b
��������
���ݸ�Ԫ����Ԫ�����ڱ��е�λ�ÿ�֪��aΪC��bΪN��cΪO��dΪF��eΪNa��fΪMg��gΪAl��hΪSi��iΪS��jΪCl��
(1)Mg��F�γɵ�����ΪMgF2��
(2)CO2���ӵĵ���ʽΪ![]() ��
��
(3)Al���ʿ���NaOH��Ӧ����������ƫ�����ƣ����ӷ���ʽΪ��2Al+2H2O+2OH-=2AlO2-+3H2����
(4)��Na��������ȼ���Եõ�����ɫ����Na2O2���������Ƶĵ���ʽΪ![]() ��
��
�ڹ��������д��������Ӻ���������֮������Ӽ�����������ԭ�Ӻ���ԭ��֮��ķǼ��Թ��ۼ���
(5)a������������ˮ���������Խǿ����ӦԪ�صķǽ�����Խǿ����a��ѡ��
b������������ˮ���������Խǿ�ǽ�����Խǿ����̬�⻯��ˮ��Һ������ǿ����ǽ������أ���bѡ��
c����H2Sˮ��Һ�м�Cl2��������Һ����ǣ�˵����������H2S����S���ʣ�˵�������������Դ���S�������ԣ��ǽ�����Խǿ���ʵ�������Խǿ����c��ѡ��
��������ѡb��

 ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�
ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д� Ʒѧ˫�ž�ϵ�д�
Ʒѧ˫�ž�ϵ�д� Сѧ��ĩ���100��ϵ�д�
Сѧ��ĩ���100��ϵ�д�����Ŀ��������(CH3OCH3)��һ��������Դ��
��֪����CO(g)��2H2(g)![]() CH3OH(g) ��H1����99kJ��mol-1
CH3OH(g) ��H1����99kJ��mol-1
��2CH3OH(g)![]() CH3OCH3(g)��H2O(g) ��H2����24kJ��mol-1
CH3OCH3(g)��H2O(g) ��H2����24kJ��mol-1
��CO(g)��H2O(g)![]() CO2(g)��H2(g) ��H3����41kJ��mol-1
CO2(g)��H2(g) ��H3����41kJ��mol-1
�ش��������⣺
��1��д��CO��H2��Ӧ����CO2��CH3OCH3(g)���Ȼ�ѧ����ʽ_____��
��2�����м�����߷�Ӧ���� CO ��ƽ��ת���ʣ���������Ӧ���ʵ���____�����ţ���
a������ѹǿ b�������¶� c������H2Ũ�� d���Ӹ�Ч����
��3����ij���º��������з�����Ӧ�ۣ���˵���÷�Ӧ�ﵽƽ�����___�����ţ���
a������ƽ����Է����������ֲ���
b����H3���ֲ���
c��![]() ���ֲ���
���ֲ���
d�������ܶȱ��ֲ���
��4����һ���¶ȣ�T�棩�£�������ܱ�������ͨ��һ����CH3OH���壬ֻ������Ӧ�ڡ�����������CH3OCH3 �����ʵ�������[��(CH3OCH3)]�뷴Ӧʱ��(t)�й����������ʾ��
t/min | 0 | 15 | 30 | 45 | 80 | 100 |
��(CH3OCH3) | 0 | 0.05 | 0.08 | 0.09 | 0.10 | 0.10 |
�ٸ��¶��£�������Ӧ��ƽ�ⳣ��KΪ___���÷�����ʾ����
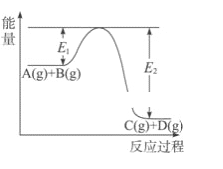
�ڷ�Ӧ����v��v����v��������v����k������2(CH3OH)��v����k������(CH3OCH3)����(H2O)��k����k ���ֱ�Ϊ�����淴Ӧ���ʳ�����![]() ֻ���¶��йء�15minʱ����___���������2λС������
ֻ���¶��йء�15minʱ����___���������2λС������
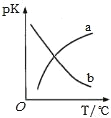
��5�����ܱ������з�����Ӧ�ۣ�ƽ�ⳣ��ΪK��pK��pK����lgK�����¶ȵĹ�ϵ��ͼ��ʾ��ͼ������___���a����b�����ܷ�ӳƽ�ⳣ���仯���ơ�
����Ŀ��(2016������) �±�ΪԪ�����ڱ���һ���֡�
̼ | �� | Y | |
X | �� | Z |
�ش��������⣺
��1��ZԪ�������ڱ��е�λ��Ϊ__________��
��2������Ԫ��ԭ�Ӱ뾶������(дԪ�ط���)__________��
��3��������ʵ��˵��YԪ�صķǽ����Ա�SԪ�صķǽ�����ǿ����__________��
a��Y������H2S��Һ��Ӧ����Һ�����
b����������ԭ��Ӧ�У�1 mol Y���ʱ�1 mol S�õ��Ӷ�
c��Y��S��Ԫ�صļ��⻯�����ȷֽ⣬ǰ�ߵķֽ��¶ȸ�
��4��X��Z��Ԫ�صĵ��ʷ�Ӧ����1 mol X����ۻ�����ָ������£�����687 kJ����֪�û�������ۡ��е�ֱ�Ϊ69 ����58 ����д���÷�Ӧ���Ȼ�ѧ����ʽ��__________��
��5��̼��þ�γɵ�1 mol������Q��ˮ��Ӧ������2 mol Mg(OH)2��1 mol��������������̼��������Ϊ9��1�����ĵ���ʽΪ__________��Q��ˮ��Ӧ�Ļ�ѧ����ʽΪ__________��
��6��ͭ��һ��Ũ�ȵ����������Ļ���ᷴӦ�����ɵ���ֻ������ͭ��ͬʱ���ɵ�������������ϱ�������Ԫ����ɣ��������Է���������С��50��Ϊ��ֹ��Ⱦ����������������ȫת��Ϊ��ۺ������Σ�����1 L 2.2 mol/L NaOH��Һ��1 mol O2������������ķ���ʽ�����ʵ����ֱ�Ϊ__________����������ͭ���ʵ���Ϊ__________��